РЕСКВЕНЦІЯ ПОВНОГО ГЕНОМА

Варіанти будови китайської популяції та їх вплив на фенотипи, захворювання та адаптацію населення
Нанопор |PacBio |Повторне секвенування геному |Виклик структурної варіації
У цьому дослідженні секвенування Nanopore PromethION було забезпечено Biomarker Technologies.
Основні моменти
У цьому дослідженні було виявлено загальний ландшафт структурних варіацій (SV) у геномі людини за допомогою тривалого секвенування на платформі Nanopore PromethION, що поглиблює розуміння SV у фенотипах, захворюваннях та еволюції.
Експериментальний дизайн
Зразки: лейкоцити периферичної крові 405 неспоріднених китайців (206 чоловіків і 199 жінок) з 68 фенотипічними та клінічними вимірюваннями.Серед усіх особин 124 особи були провінціями на півночі, 198 — на півдні, 53 — на південному заході, а 30 — невідомі.
Стратегія секвенування: секвенування тривалого зчитування всього геному (LRS) із зчитуванням Nanopore 1D і зчитуванням PacBio HiFi.
Платформа секвенування: Nanopore PromethION;PacBio Продовження II
Виклик варіації структури
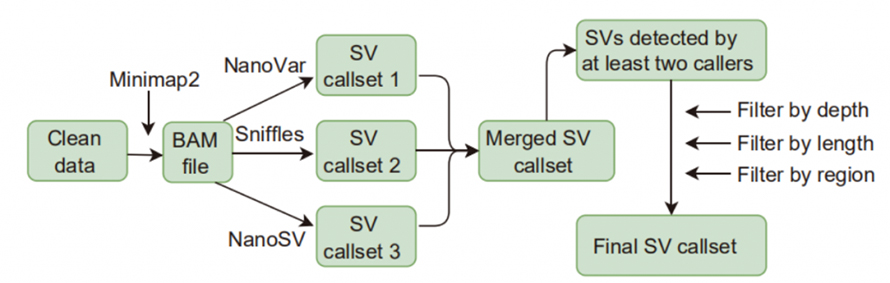
Рисунок 1. Робочий процес виклику та фільтрації SV
Основні досягнення
Виявлення та перевірка варіацій структури
Набір даних Nanopore: загалом 20,7 ТБ чистих зчитувань, згенерованих на платформі секвенування PromethION, досягаючи в середньому 51 ГБ даних на зразок, прибл.17-кратної глибини.
Вирівнювання референсного генома (GRCh38): було досягнуто середньої частоти картування 94,1%.Середній рівень помилок (12,6%) був подібним до попереднього порівняльного дослідження (12,6%) (рис. 2b і 2c)
Виклик зміни структури (SV): виклики SV, застосовані в цьому дослідженні, включали Sniffles, NanoVar і NanoSV.SV з високою достовірністю визначалися як SV, ідентифіковані принаймні двома абонентами та пройшли фільтрацію за глибиною, довжиною та регіоном.
У кожному зразку було ідентифіковано в середньому 18 489 (від 15 439 до 22 505) SV з високою достовірністю.(Рис. 2d, 2e і 2f)
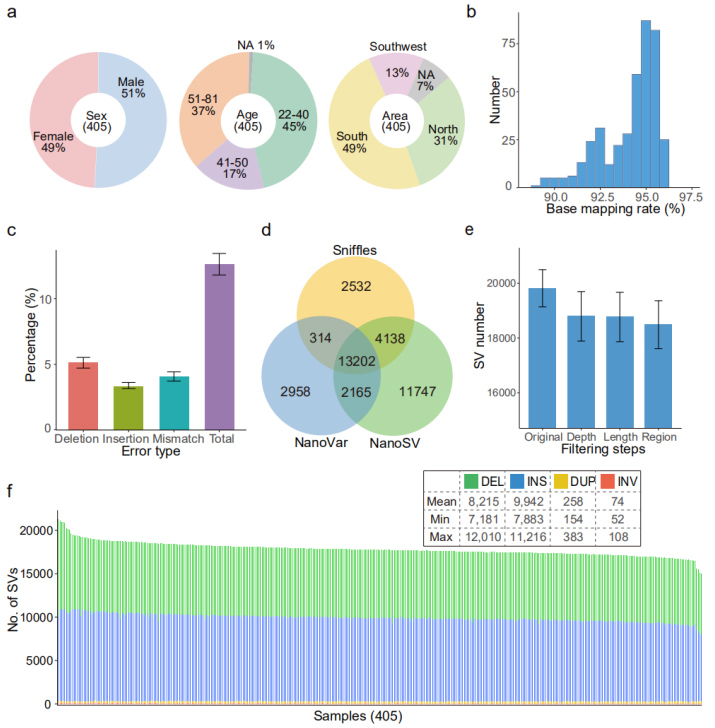
Рисунок 2. Загальний ландшафт SV, визначених набором даних Nanopore
Перевірка PacBio: SV, ідентифіковані в одному зразку (HG002, дочірній), були перевірені набором даних PacBio HiFi.Загальна частота помилкових виявлень (FDR) становила 3,2%, що свідчить про відносно надійну ідентифікацію SV за допомогою зчитування Nanopore.
Ненадлишкові SV і геномні особливості
Ненадлишкові SV: Набір із 132 312 ненадлишкових SV було отримано шляхом злиття SV у всіх зразках, який включає 67 405 DEL, 60 182 INS, 3956 DUP і 769 INV.(Малюнок 3а)
Порівняння з існуючими наборами даних SV: цей набір даних порівнювали з опублікованим набором даних TGS або NGS.Серед чотирьох порівнюваних наборів даних LRS15, який також є єдиним набором даних із платформи довгозчитуваного секвенування (PacBio), мав найбільше збігів із цим набором даних.Крім того, про 53,3% (70 471) SV у цьому наборі даних було повідомлено вперше.Розглядаючи кожен тип SV, кількість відновлених INS із набором даних секвенування тривалого зчитування була набагато більшою, ніж кількість інших із коротким зчитуванням, що вказує на те, що секвенування тривалого зчитування є особливо ефективним у виявленні INS.(Рис. 3b і 3c)
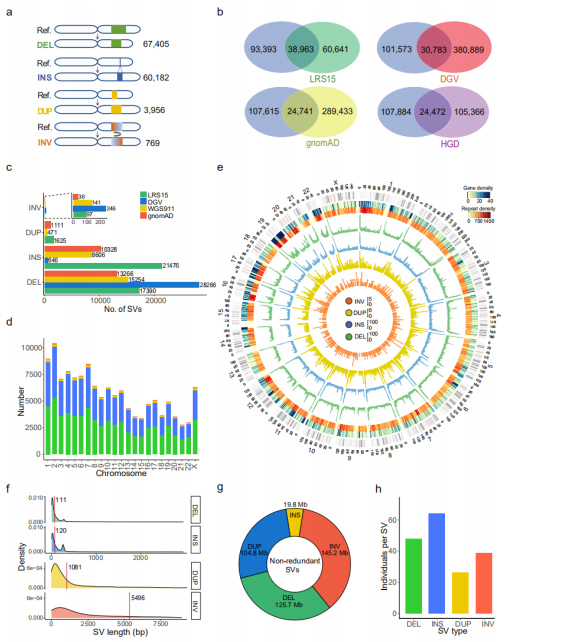
Рисунок 3. Властивості нерезервованих SV для кожного типу SV
Геномні особливості: було виявлено, що кількість SV значно корелює з довжиною хромосоми.Розподіл генів, повтори, DEL (зелений), INS (синій), DUP (жовтий) і INV (помаранчевий) були відображені на діаграмі Circos, де загальне збільшення SV спостерігалося в кінці плечей хромосоми.(Рис. 3d і 3e)
Довжина SV: було виявлено, що довжини INS і DEL були значно коротшими, ніж довжини DUP і INV, що узгоджується з тими, що визначені набором даних PacBio HiFi.Довжина всіх ідентифікованих SV склала 395,6 Мб, що займало 13,2% всього геному людини.SV вражали в середньому 23,0 Mb (приблизно 0,8%) геному на людину.(Рис. 3f і 3g)
Функціональні, фенотипові та клінічні впливи СВ
Прогнозована втрата функції (pLoF) SV: pLoF SV визначалися як SV, які взаємодіяли з CDS, де кодуючі нуклеотиди були видалені або ORF були змінені.Загалом було анотовано 1929 pLoF SV, що впливають на CDS 1681 гена.Серед них 38 генів підкреслили «зв’язування з рецептором імуноглобуліну» в аналізі збагачення GO.Ці pLoF SV були додатково анотовані GWAS, OMIM і COSMIC відповідно.(Рис. 4а і 4б)
Фенотипово та клінічно значущі SV: ряд SV у наборі даних про нанопори виявилися фенотипово та клінічно значущими.Рідкісний гетерозиготний DEL розміром 19,3 kb, який, як відомо, викликає альфа-таласемію, був ідентифікований у трьох осіб, у яких порушено функціонування генів субодиниці альфа 1 і 2 гемоглобіну (HBA1 і HBA2).Інший DEL розміром 27,4 kb на гені, що кодує субодиницю бета гемоглобіну (HBB), був ідентифікований в іншої людини.Відомо, що цей SV викликає серйозні гемоглобінопатії.(Малюнок 4c)
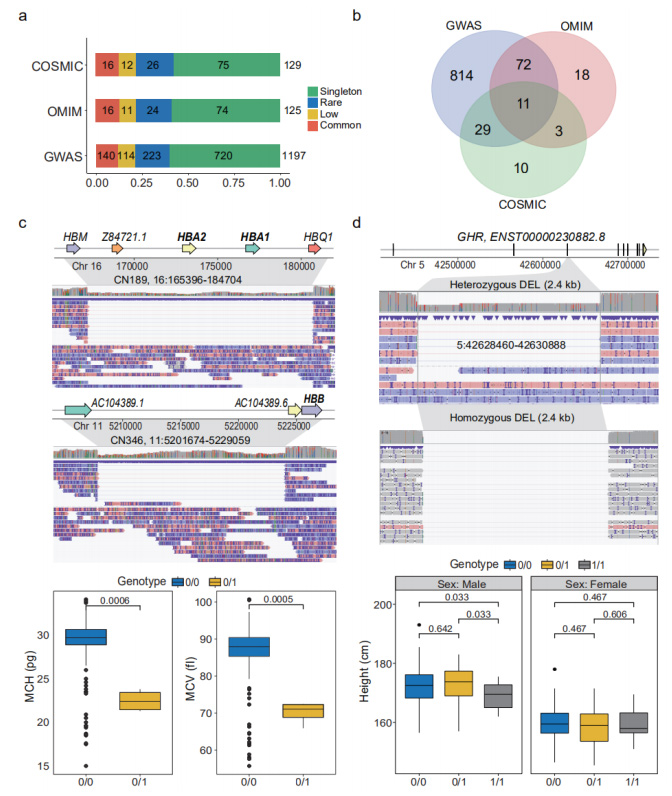
Рисунок 4. pLoF SVs, пов’язані з фенотипами та захворюваннями
Загальний DEL розміром 2,4 kb спостерігався у 35 гомозиготних і 67 гетерозиготних носіїв, що охоплює повну область 3-го екзону рецептора гомона росту (GHR).Гомозиготні носії виявилися значно нижчими за гетерзиготні (р=0,033).(Малюнок 4d)
Крім того, ці SV були оброблені для еволюційних досліджень населення між двома регіональними групами: Північним і Південним Китаєм.Значно диференційовані SV були розподілені на Chr 1, 2, 3, 6, 10, 12, 14 і 19, у межах яких верхні були пов’язані з областями імунітету, такими як IGH, MHC тощо. Розумно припустити, що диференціація в цих SV може бути спричинена генетичним дрейфом і тривалим впливом різноманітних середовищ для субпопуляцій у Китаї.
довідка
Wu, Zhikun та ін.«Структурні варіанти китайської популяції та їхній вплив на фенотипи, захворювання та адаптацію населення».bioRxiv(2021).
Новини та основні моменти спрямований на обмін останніми успішними випадками з Biomarker Technologies, фіксацію нових наукових досягнень, а також видатних методів, застосованих під час дослідження.
Час публікації: 06 січня 2022 р

