МЕТАГЕНОМІКА

Повні закриті бактеріальні геноми з мікробіомів за допомогою секвенування нанопор
Секвенування нанопор |Метагеноміка |MAGs |Циркуляризація геному бактерій |Мікробіота кишечника
Основні моменти
1. У цьому дослідженні було представлено новий метод виділення довгих фрагментів ДНК, який дозволив виділити мікрограм чистої високомолекулярної ДНК, придатної для тривалого секвенування з 300 мг калу.
2. У цьому дослідженні було представлено робочий процес складання, Lathe, де MAG збиралися за допомогою довгих зчитувань і виправлялися за допомогою коротких зчитувань.
3. Токарний станок оцінювався за допомогою макетної суміші.7 з 12 бактерій були успішно зібрані в один контиг, а 3 були зібрані в чотири або менше контигів.
4.Lathe було застосовано до зразків стільця, які створили 20 циркулярних геномів, включаючи Prevotella copri і кандидата Cibiobacter sp., які були відомі багатством мобільних генетичних елементів.
Головне досягнення
Протокол вилучення ДНК HWM
Метагеномні дослідження кишківника, засновані на довгостроковому секвенуванні, протягом тривалого часу страждали від труднощів вилучення високомолекулярної (HMW) ДНК з калу.У цьому дослідженні було запроваджено протокол екстракції на основі ферментів, щоб уникнути значного зсуву за допомогою збивання бісеру традиційними методами.Як показано на наступному малюнку, зразки спочатку обробляли сумішшю ферментів, включаючи літичний фермент, MetaPolyzyme тощо, щоб руйнувати клітинні стінки.Вивільнену ДНК екстрагували фенол-хлороформною системою з подальшим розщепленням протеїназою К і РНКазою А, очищенням на основі колонки та відбором розміру SPRI.За допомогою цього методу вдалося отримати мікрограми HMW ДНК із 300 м калу, що відповідає давно зчитуваним вимогам секвенування як щодо якості, так і кількості.
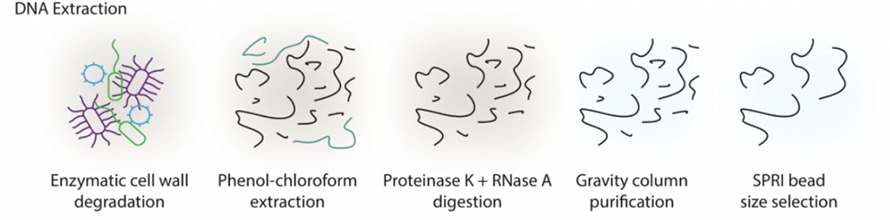
Рисунок 1. Схема екстракції ДНК HWM
Схема потоку токарного верстата
Як описано на наступному малюнку, Lathe містить існуючий процес необробленого процесу базового виклику за допомогою Guppy.Потім Flye і Canu створюють дві довгозчитувані збірки окремо, після чого виявляють і видаляють неправильну збірку.Дві збірки об’єднано за допомогою функції швидкого злиття.Після злиття великі збірки на рівні мегабази потім перевіряються на цикліфікацію.Згодом консенсусне уточнення цих збірок обробляється за допомогою короткого читання.Остаточно зібрані бактеріальні геноми обробляються для остаточного виявлення та видалення неправильної збірки.
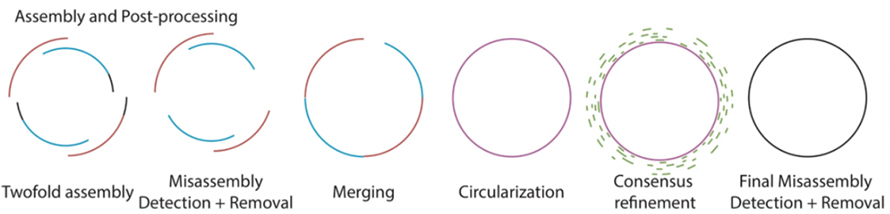
Рисунок 2. Схема технологічного процесу складання токарного верстата
Оцінка токарного верстата з імітаційною сумішшю бактерій
Для оцінки продуктивності платформи для секвенування нанопор і Lathe у збірці MAG використовували стандартну суміш 12 видів ATCC, яка містила як грампозитивні, так і грамнегативні бактерії.Всього 30,3 Гб даних було згенеровано платформою нанопор з N50 5,9 кб.Lathe суттєво покращив складання N50 в 1,6-4 рази порівняно з іншими інструментами для складання, які давно прочитали, і в 2-9 разів порівняно з гібридними інструментами складання.З 12 бактеріальних геномів сім були зібрані в окремі контиги (Малюнок 3. Циркос із чорною крапкою).Ще три були зібрані в чотири або менше контигів, у яких найбільш неповна збірка містила 83% геному в одному контигу.
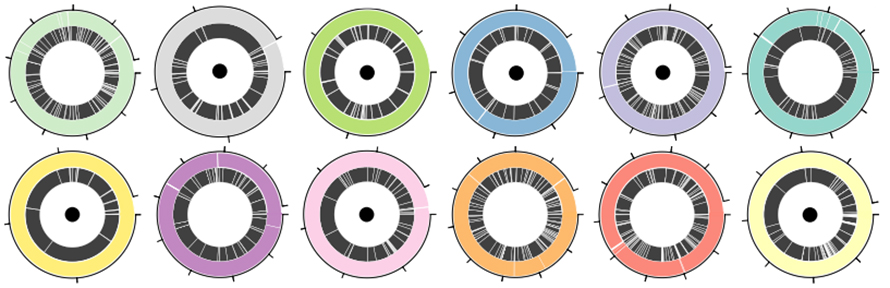
Малюнок 3. Геномні збірки в певній бактеріальній суміші з 12 видів
Застосування Lathe у зразках стільця
Далі цей метод було застосовано до зразків людського стільця, щоб порівняти ідентифікацію організму та суміжність збірки з існуючими методами, аналізом на основі хмарного читання та короткого читання.З трьох залучених зразків нова екстракція на основі ферментів дала принаймні 1 мкг на 300 мг введеної маси.Секвенування нанопор цієї HMW ДНК дало тривале зчитування з N50 4,7 kb, 3,0 kb і 3,0 kb відповідно.Примітно, що цей метод показав великий потенціал у виявленні мікробів порівняно з існуючими методами.Тут було показано відносно вищу альфа-різноманітність на видовому рівні порівняно з коротким читанням і хмарним читанням.Крім того, за допомогою цього методу були виділені всі роди з аналізу короткого зчитування, навіть типово стійкі до лізису грампозитивні організми.
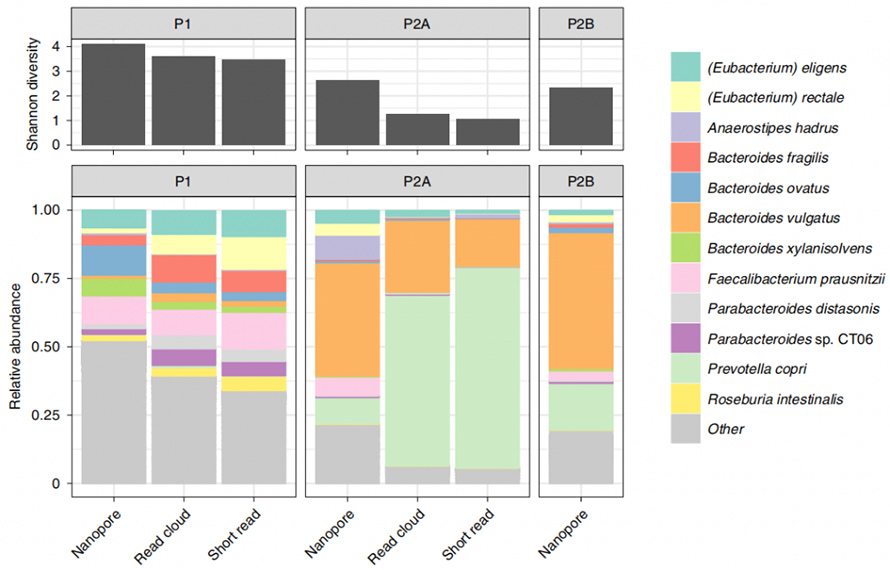
Рисунок 4. Альфа-різноманіття та таксономічні компоненти, визначені методами Nanopore, короткого читання та хмарного читання
Lathe показав набагато довший збірник N50, ніж вузол для короткого читання та читання з хмари, незважаючи на введення необроблених даних у три-шість разів менше.Чернетки геномів створювали шляхом групування контигів, у якому чернетки класифікували на «високоякісні» та «часткові» на основі повноти, забруднення, однокопійних основних генів тощо. Довгозчитуване складання показало набагато вищу суміжність за нижчу вартість порівняно з для короткого читання та читання в хмарі.
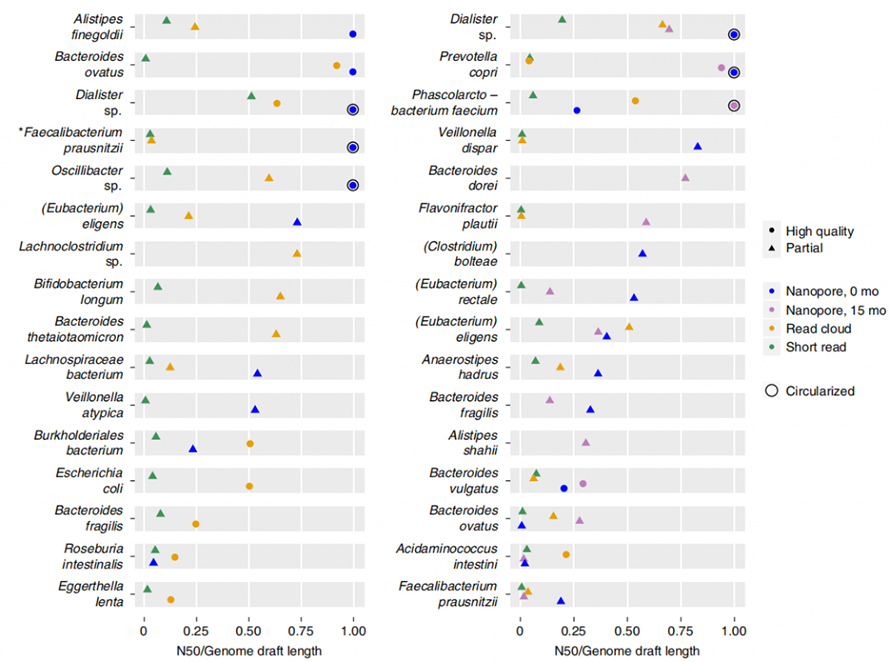
Малюнок 5. Суміжність збірки кожного методу для кожного організму
Крім того, сучасний підхід збірки здатний давати замкнуті кільцеві геноми.У зразках калу було зібрано вісім високоякісних геномів з одним контигом, і п’ять із них досягли точної циркуляризації.Підхід тривалого читання також продемонстрував вражаючу здатність розпізнавати повторювані елементи в геномах.ЦиркуляризованийP. copriгеном був створений за допомогою цього підходу, який, як відомо, містить високий ступінь повторення послідовності.Найкраща збірка цього геному за допомогою короткого зчитування та зчитування в хмарі ніколи не перевищувала N50 у 130 кб, навіть із глибиною покриття 4800X.Ці елементи з великою кількістю копій були повністю вирішені за допомогою підходу тривалого читання, який часто зустрічається на точках розриву збірок короткого читання або хмарного читання.У цьому дослідженні повідомлялося про інший закритий геном, який, як вважалося, був членом нещодавно описаногоЦибіобактерклада.П'ять передбачуваних фагів було ідентифіковано в цій закритій збірці розміром від 8,5 до 65,9 кб.
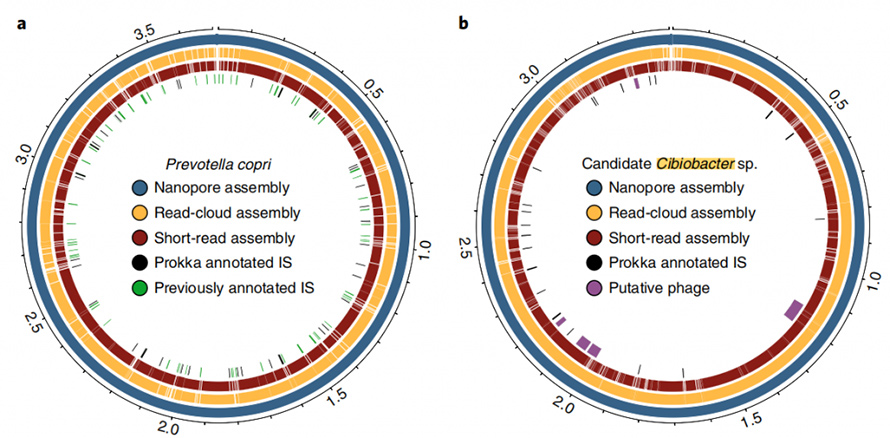
Рисунок 6. Діаграма Circos закритих геномів P.copri та Cibiobacter sp.
довідка
Мосс, Е.Л., Магіні, Д.Г., Бхатт, А.С. (2020).Повні закриті бактеріальні геноми з мікробіомів за допомогою секвенування нанопор.Біотехнологія природи,38(6), 701-707.
Техніка та основні моменти має на меті поділитися найновішим успішним застосуванням різних високопродуктивних технологій секвенування в різних дослідницьких сферах, а також блискучими ідеями в експериментальному дизайні та аналізі даних.
Час публікації: 07 січня 2022 р

