
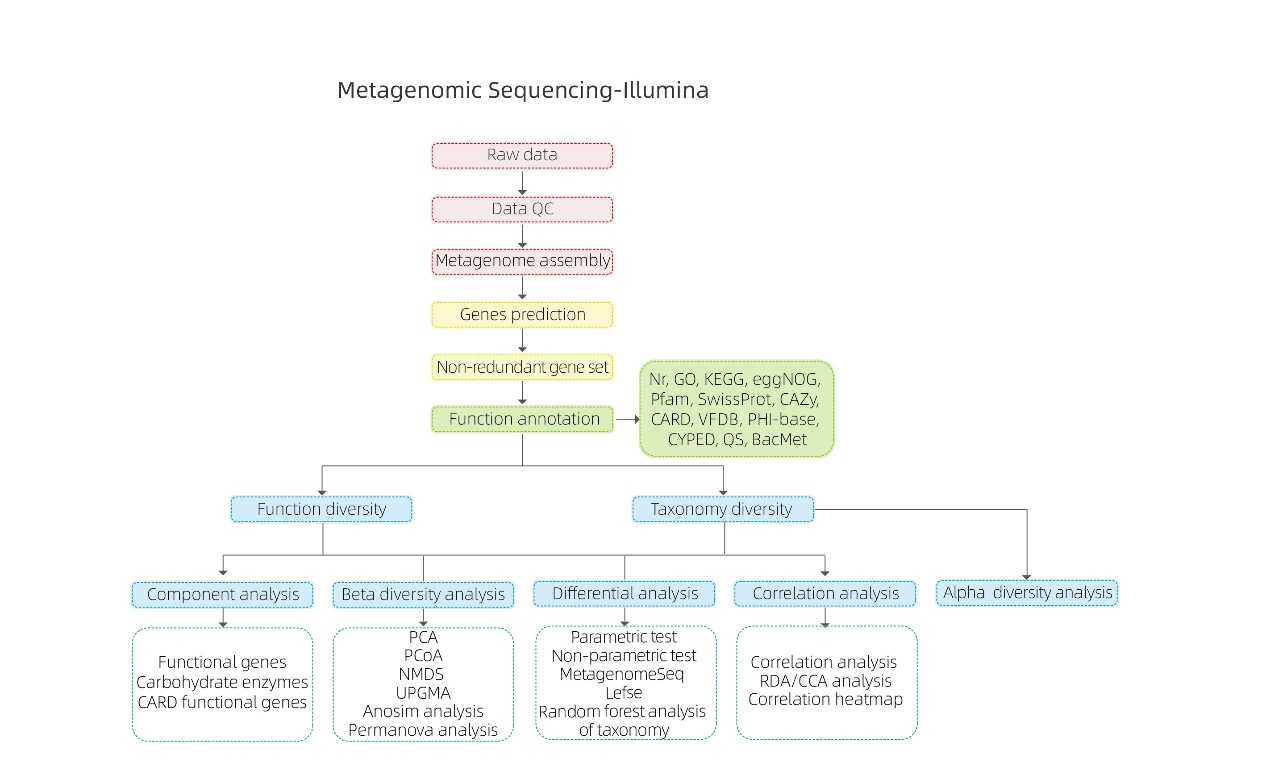
Метагеномне секвенування -NGS
Переваги сервісу
● Без ізоляції та культивування для профілювання мікробної спільноти
● Висока роздільна здатність для виявлення видів з низькою чисельністю в зразках навколишнього середовища
● Ідея «мета-» об’єднує всі біологічні особливості на функціональному, видовому та генному рівнях, що відображає динамічний погляд, ближчий до реальності.
● BMK накопичує величезний досвід у різних типах зразків, оброблених понад 10 000 зразків.
Специфікації послуги
| Платформа | Секвенування | Рекомендовані дані | Час обороту |
| Платформа Illumina NovaSeq | PE150 | 6 G/10 G/20 G | 45 робочих днів |
Біоінформаційні аналізи
● Контроль якості необроблених даних
● Збірка метагеному
● Ненадлишковий набір генів і анотація
● Аналіз видового різноманіття
● Аналіз різноманітності генетичних функцій
● Міжгруповий аналіз
● Аналіз асоціацій проти експериментальних факторів
Вимоги до зразків і доставка
Вимоги до зразків:
дляекстракти ДНК:
| Тип зразка | Сума | Концентрація | Чистота |
| екстракти ДНК | > 30 нг | > 1 нг/мкл | OD260/280= 1,6-2,5 |
Для екологічних зразків:
| Тип зразка | Рекомендована процедура відбору проб |
| грунт | Кількість проби: прибл.5 г;Залишки засохлого речовини необхідно видалити з поверхні;Великі шматки подрібнити і пропустити через фільтр 2 мм;Аліквоти зразків у стерильній ЕР-пробірці або циропробірці для резервування. |
| Фекалії | Кількість проби: прибл.5 г;Зберіть та аліквотуйте зразки в стерильну EP-пробірку або кріопробірку для резервування. |
| Кишковий вміст | Зразки необхідно обробляти в асептичних умовах.Промийте зібрану тканину PBS;Центрифугуйте PBS і зберіть осад в EP-пробірки. |
| Шлам | Кількість проби: прибл.5 г;Зберіть і аліквотуйте зразок осаду в стерильну ЕР-пробірку або кріопробірку для резервування |
| Водний об'єкт | Для зразка з обмеженою кількістю мікроорганізмів, наприклад водопровідної води, колодязної води тощо, наберіть принаймні 1 л води та пропустіть її через фільтр 0,22 мкм, щоб збагатити мікроорганізми на мембрані.Зберігайте мембрану в стерильній пробірці. |
| Шкіра | Обережно поскрібайте поверхню шкіри стерильним ватним тампоном або хірургічним лезом і помістіть його в стерильну пробірку. |
Рекомендована доставка зразків
Заморожуйте зразки в рідкому азоті протягом 3-4 годин і зберігайте в рідкому азоті або -80 градусів для тривалого зберігання.Потрібна доставка зразків із сухим льодом.
Потік роботи служби
Доставка зразків
Будівництво бібліотеки
Секвенування

Аналіз даних
Післяпродажне обслуговування
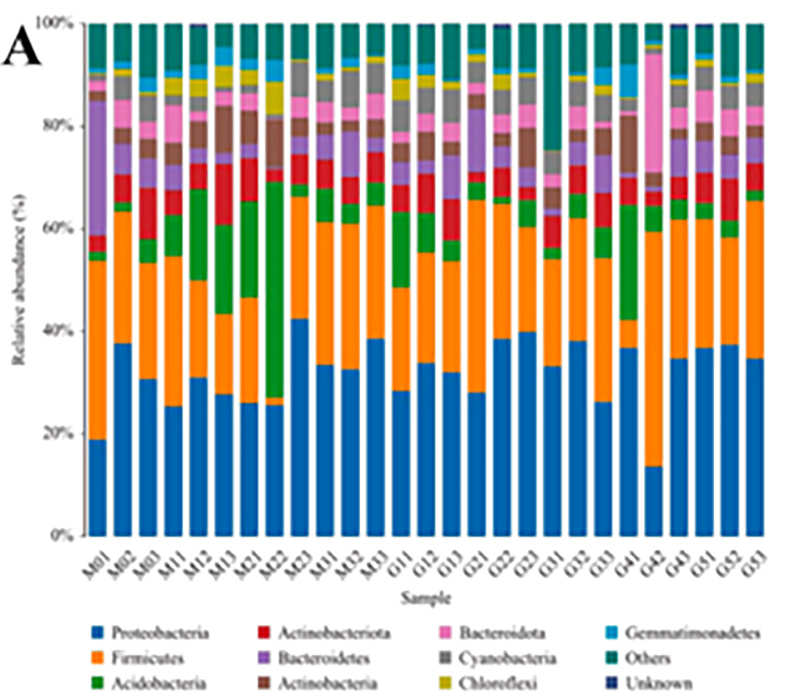
1.Гістограма: розподіл видів
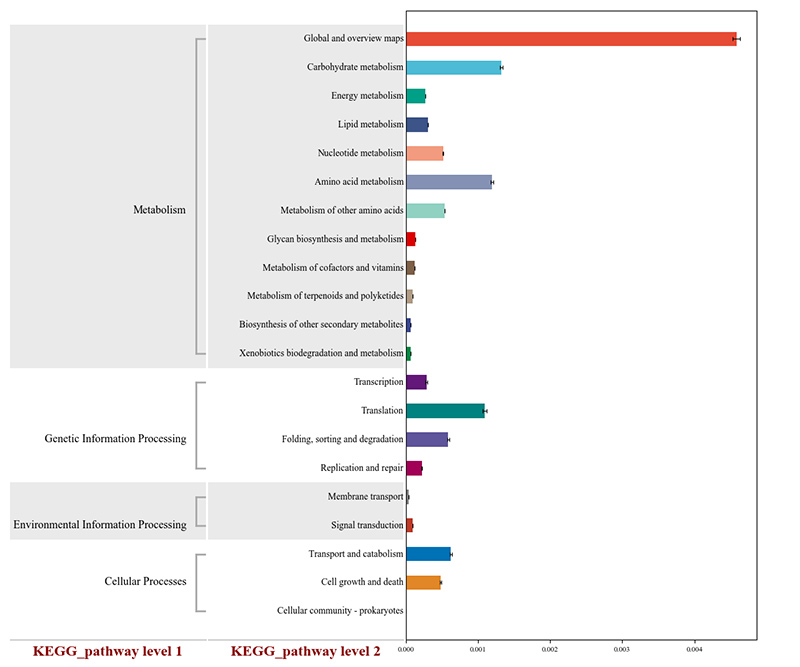
2. Функціональні гени, анотовані до метаболічних шляхів KEGG
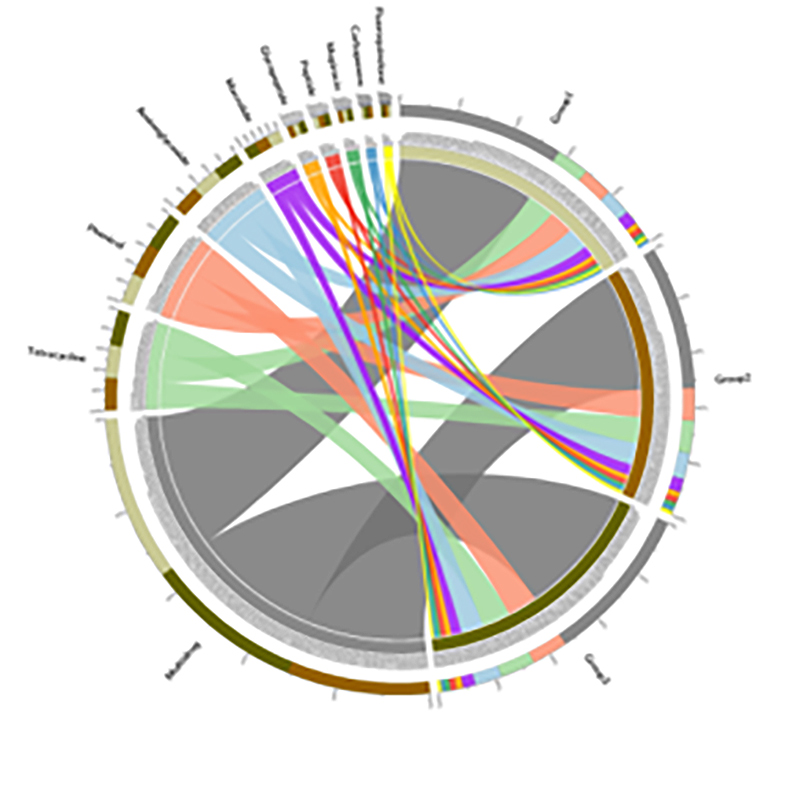
3. Теплова карта: диференціальні функції на основі відносної кількості генів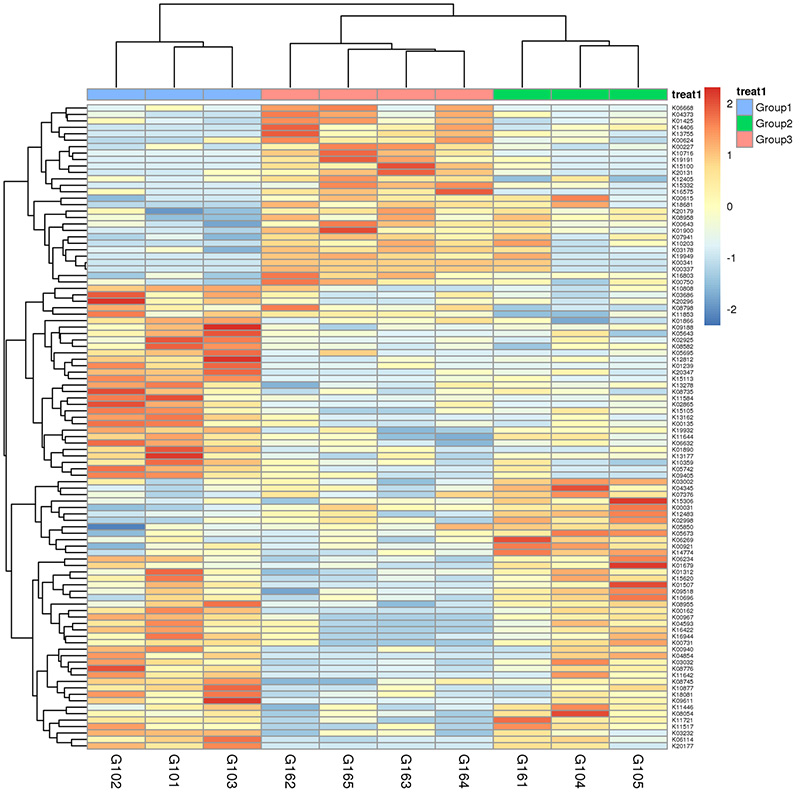 4.Circos генів стійкості до антибіотиків CARD
4.Circos генів стійкості до антибіотиків CARD
Корпус БМК
Поширеність генів резистентності до антибіотиків і бактеріальних патогенів уздовж ґрунтово-мангрового кореневого континууму
Опубліковано:Журнал небезпечних матеріалів, 2021
Стратегія послідовності:
Матеріали: екстракти ДНК чотирьох фрагментів асоційованих зразків кореня мангрового дерева: незасаджений ґрунт, ризосфера, епісфера та ендосфера.
Платформа: Illumina HiSeq 2500
Цілі: метагеном
Область V3-V4 гена 16S рРНК
Ключові результати
Для вивчення поширення генів стійкості до антибіотиків (ARG) із ґрунту в рослини було оброблено метагеномне секвенування та меташтрих-кодування континууму ґрунт-корінь саджанців мангрових дерев.Метагеномні дані показали, що 91,4% генів стійкості до антибіотиків були зазвичай ідентифіковані у всіх чотирьох компартментах ґрунту, згаданих вище, що показало постійний характер.Секвенування ампліконів 16S рРНК дало 29 285 послідовностей, що представляють 346 видів.У поєднанні з профілюванням видів за допомогою секвенування ампліконів було виявлено, що це поширення не залежить від пов’язаної з коренем мікробіоти, однак воно може сприятися рухомістю генетичних елементів.Це дослідження виявило потік АРГ і патогенів із ґрунту в рослини через взаємопов’язаний континуум ґрунт-корінь.
довідка
Ван, Ч., Ху, Р., Стронг, П. Дж., Чжуан, В., і Шу, Л.(2020).Поширеність генів стійкості до антибіотиків і бактеріальних патогенів уздовж континууму ґрунт–мангровий корінь.Журнал небезпечних матеріалів, 408, 124985.











