BÜTÜN GENOM YENİDEN SIRALAMA

Çin popülasyonundaki yapı değişkenleri ve bunların fenotipler, hastalıklar ve popülasyon adaptasyonu üzerindeki etkileri
Nanogözenek |PacBio |Tüm genomun yeniden dizilenmesi |Yapısal varyasyon çağrısı
Bu çalışmada Nanopore PromethION dizilimi Biomarker Technologies tarafından sağlanmıştır.
Öne Çıkanlar
Bu çalışmada, fenotipler, hastalıklar ve evrimdeki SV'lerin anlaşılmasını derinleştiren Nanopore PromethION platformunda uzun süreli okunan sıralama yardımıyla insan genomundaki yapısal varyasyonların (SV'ler) genel bir görünümü ortaya çıkarıldı.
Deneysel tasarım
Örnekler: 68 fenotipik ve klinik ölçümle ilgisiz 405 Çinli bireyin (206 erkek ve 199 kadın) periferik kan lökositleri.Tüm bireylerden 124 kişinin ata bölgesi Kuzeyde, 198 kişinin ata bölgesi Güneyde, 53 kişinin ata bölgesi Güneybatıda ve 30 kişinin ise bilinmiyordu.
Sıralama stratejisi: Nanopore 1D okumaları ve PacBio HiFi okumaları ile tüm genomun uzun okumalı dizilimi (LRS).
Sıralama platformu: Nanopore PromethION;PacBio Devam II
Yapı Değişikliği Çağrısı
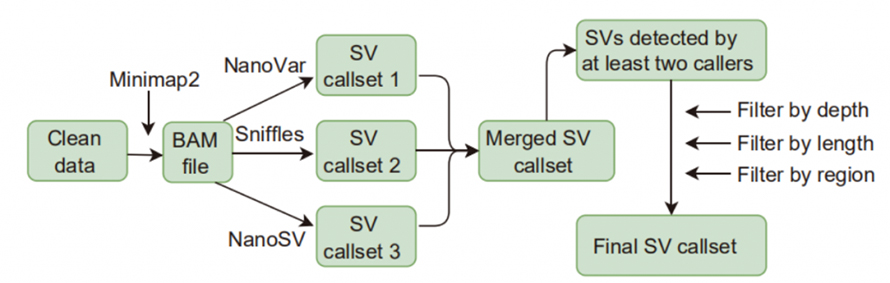
Şekil 1. SV arama ve filtreleme iş akışı
Ana başarılar
Yapı varyasyonunun keşfi ve doğrulanması
Nanopore tarih kümesi: PromethION sıralama platformunda oluşturulan toplam 20,7 Tb temiz okuma, örnek başına ortalama 51 Gb veriye ulaşıyor, yani yaklaşık.17 kat derinlik.
Referans genom hizalaması (GRCh38): Ortalama %94,1 haritalama oranına ulaşıldı.Ortalama hata oranı (%12,6) önceki kıyaslama çalışmasına (%12,6) benzerdi (Şekil 2b ve 2c)
Yapı varyasyonu (SV) çağrısı: Bu çalışmada uygulanan SV arayanlar Sniffles, NanoVar ve NanoSV'yi içeriyordu.Güvenilirliği yüksek SV'ler, en az iki arayan tarafından tanımlanan ve derinlik, uzunluk ve bölgeye göre filtrelemelerden geçen SV'ler olarak tanımlandı.
Her örnekte ortalama 18.489 (15.439 ila 22.505 arasında değişen) yüksek güvenirli SV tanımlandı.(Şekil 2d, 2e ve 2f)
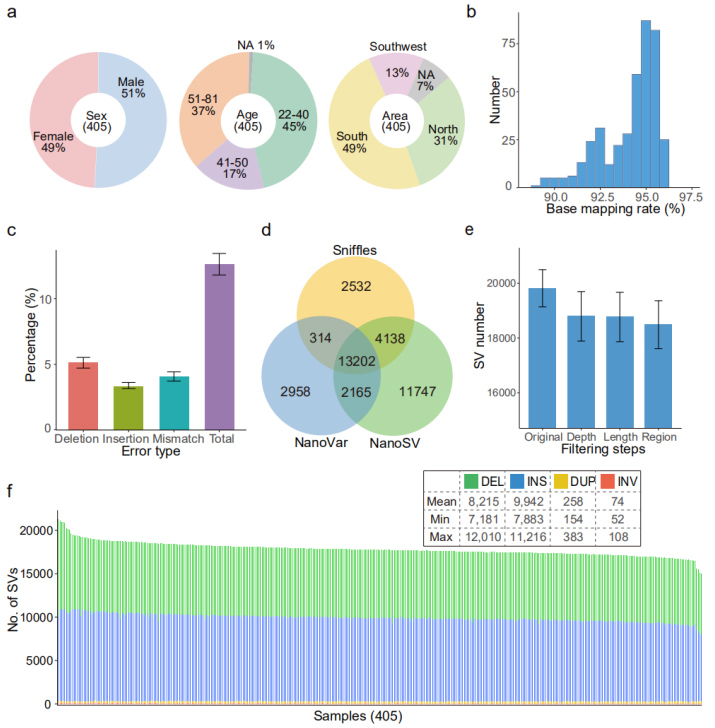
Şekil 2. Nanopore veri seti tarafından tanımlanan SV'lerin genel görünümü
PacBio ile doğrulama: Bir örnekte (HG002, alt) tanımlanan SV'ler, bir PacBio HiFi veri seti tarafından doğrulandı.Genel yanlış keşif oranı (FDR) %3,2 olup, Nanopore okumaları ile nispeten güvenilir bir SV tanımlamasını göstermektedir.
Yedeksiz SV'ler ve genomik özellikler
Yedeksiz SV'ler: 67.405 DEL, 60.182 INS, 3.956 DUP ve 769 INV içeren tüm örneklerdeki SV'lerin birleştirilmesiyle 132.312 yedeksiz SV kümesi elde edildi.(Şekil 3a)
Mevcut SV veri kümeleriyle karşılaştırma: Bu veri kümesi, yayınlanmış TGS veya NGS veri kümesiyle karşılaştırıldı.Karşılaştırılan dört veri kümesi içinde, aynı zamanda uzun okumalı sıralama platformunun (PacBio) tek veri kümesi olan LRS15, bu veri kümesiyle en büyük örtüşmeleri paylaştı.Ayrıca bu veri setindeki SV'lerin %53,3'ü (70.471) ilk kez rapor edildi.Her bir SV türüne bakıldığında, uzun okuma sıralama veri kümesine sahip kurtarılan INS'lerin sayısı, geri kalan kısa okuma olanlardan çok daha fazlaydı; bu da uzun okuma sıralamasının INS tespitinde özellikle etkili olduğunu gösteriyor.(Şekil 3b ve 3c)
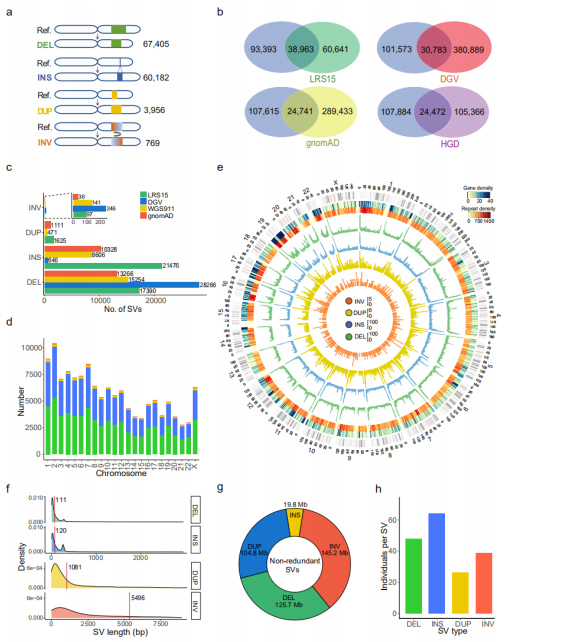
Şekil 3. Her SV türü için yedeksiz SV'lerin özellikleri
Genomik özellikler: SV sayısı ile kromozom uzunluğu arasında anlamlı ilişki bulundu.Genlerin, tekrarların, DEL'lerin (yeşil), INS'nin (mavi), DUP'nin (sarı) ve INV'nin (turuncu) dağılımı Circos diyagramında gösterildi ve burada kromozom kollarının sonunda SV'de genel bir artış gözlendi.(Şekil 3d ve 3e)
SV'lerin uzunluğu: INS'lerin ve DEL'lerin uzunluklarının, PacBio HiFi veri kümesi tarafından tanımlananlarla uyumlu olan DUP'lar ve INV'lerden önemli ölçüde daha kısa olduğu bulundu.Tanımlanan tüm SV'lerin uzunluğu, tüm insan genomunun %13,2'sini kaplayan 395,6 Mb'ye kadar eklendi.SV'ler kişi başına ortalama 23,0 Mb (yaklaşık %0,8) genomu etkiledi.(Şekil 3f ve 3g)
SV'lerin fonksiyonel, fenotipik ve klinik etkileri
Tahmin edilen fonksiyon kaybı (pLoF) SV'ler: pLoF SV'ler, kodlayıcı nükleotidlerin silindiği veya ORF'lerin değiştirildiği CDS ile etkileşime giren SV'ler olarak tanımlandı.1.681 genin CDS'sini etkileyen toplam 1.929 pLoF SV'ye açıklama eklenmiştir.Bunlar arasında 38 gen, GO zenginleştirme analizinde "immünoglobulin reseptör bağlanmasını" vurguladı.Bu pLoF SV'leri sırasıyla GWAS, OMIM ve COSMIC tarafından ayrıca açıklanmıştır.(Şekil 4a ve 4b)
Fenotipik ve klinik olarak ilgili SV'ler: Nano gözenek veri setindeki bir dizi SV'nin fenotipik ve klinik olarak alakalı olduğu gösterilmiştir.Alfa-talasemiye neden olduğu bilinen 19,3 kb'lik nadir bir heterozigot DEL, Hemoglobin Alt Birimi Alfa 1 ve 2'nin (HBA1 ve HBA2) genlerini işlevsiz hale getiren üç kişide tanımlandı.Hemoglobin Alt Birimi Beta'yı (HBB) kodlayan gen üzerinde 27.4 kb'lik başka bir DEL başka bir bireyde tanımlandı.Bu SV'nin ciddi hemoglobinopatilere neden olduğu biliniyordu.(Şekil 4c)
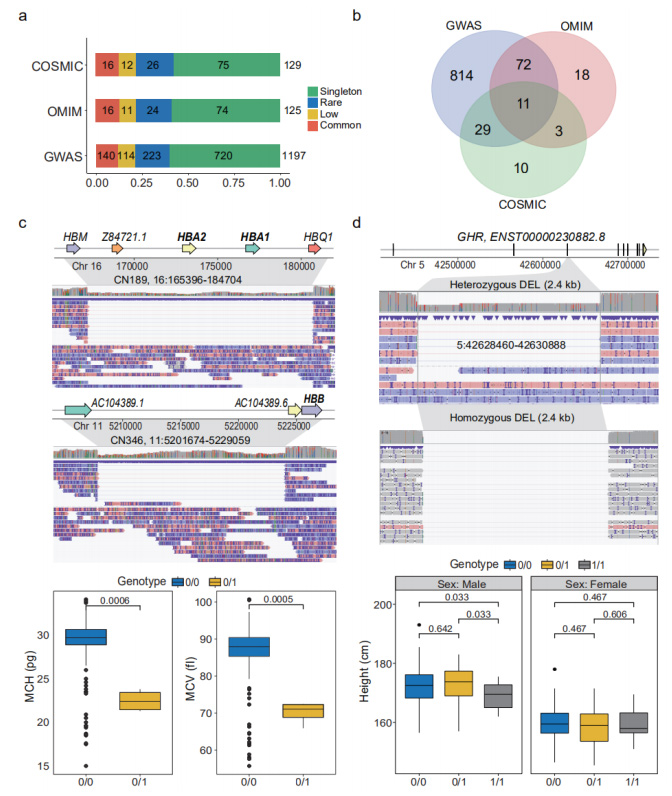
Şekil 4. Fenotipler ve hastalıklarla ilişkili pLoF SV'leri
Büyüme Homon Reseptörünün (GHR) 3. eksonunun tüm bölgesini kapsayan 35 homozigot ve 67 heterozigot taşıyıcıda 2,4 kb'lik ortak bir DEL gözlendi.Homozigot taşıyıcıların heterozigot taşıyıcılara göre anlamlı derecede kısa olduğu görüldü(p=0,033).(Şekil 4d)
Ayrıca bu SV'ler, iki bölgesel grup arasındaki popülasyon evrimi çalışmaları için işlendi: Kuzey ve Güney Çin.Önemli ölçüde farklı SV'lerin Chr 1, 2, 3, 6,10,12,14 ve 19'da dağıtıldığı bulundu; bunların içinde en üsttekiler IGH, MHC, vb. gibi bağışıklık bölgeleriyle ilişkilendirildi. Bu SV'lerdeki farklılaşma, genetik sürüklenme ve Çin'deki alt popülasyonlar için uzun süreli farklı ortamlara maruz kalma nedeniyle olabilir.
Referans
Wu, Zhikun ve diğerleri."Çin popülasyonundaki yapısal değişkenler ve bunların fenotipler, hastalıklar ve popülasyon adaptasyonu üzerindeki etkileri."bioRxiv(2021).
Haberler ve Öne Çıkanlar Biomarker Technologies ile en son başarılı vakaları paylaşmayı, yeni bilimsel başarıların yanı sıra çalışma sırasında uygulanan öne çıkan teknikleri yakalamayı amaçlamaktadır.
Gönderim zamanı: Ocak-06-2022

