
Secvențierea metagenomică -NGS
Avantajele serviciului
● Fără izolare și cultivare pentru profilarea comunității microbiene
● Rezoluție înaltă în detectarea speciilor cu abundență scăzută în probele de mediu
● Ideea de „meta-” integrează toate trăsăturile biologice la nivel funcțional, la nivel de specie și la nivel de genă, ceea ce reflectă o viziune dinamică care este mai aproape de realitate.
● BMK acumulează o experiență masivă în diverse tipuri de mostre, cu peste 10.000 de mostre procesate.
Specificații de service
| Platformă | Secvențierea | Date recomandate | Timp de răspuns |
| Platforma Illumina NovaSeq | PE150 | 6 G/10 G/20 G | 45 de zile lucrătoare |
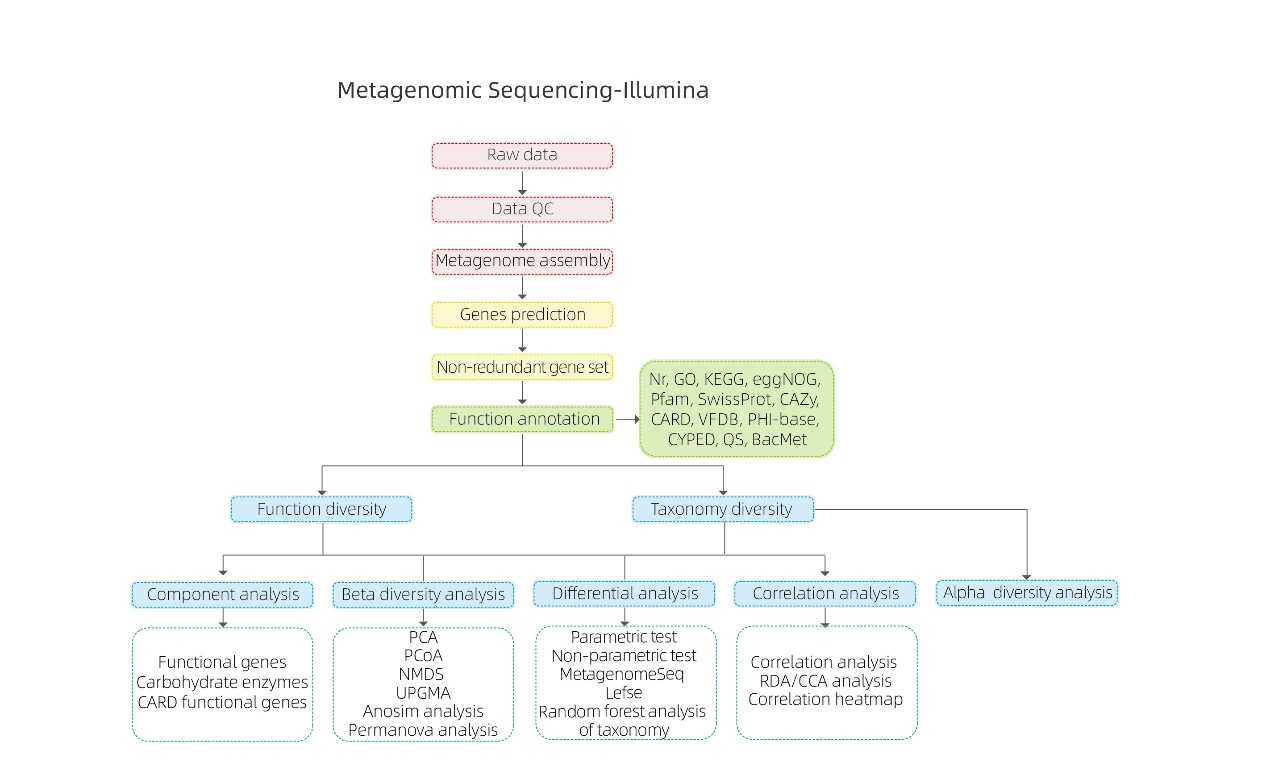
Analize bioinformatice
● Controlul calității datelor brute
● Ansamblu metagenom
● Setul de gene neredundante și adnotare
● Analiza diversităţii speciilor
● Analiza diversităţii funcţiilor genetice
● Analiza inter-grup
● Analiza de asociere cu factori experimentali
Cerințe pentru mostre și livrare
Cerințe pentru eșantion:
Pentruextracte de ADN:
| Tip eșantion | Cantitate | Concentraţie | Puritate |
| extracte de ADN | > 30 ng | > 1 ng/μl | OD260/280= 1,6-2,5 |
Pentru mostre de mediu:
| Tipul eșantionului | Procedura de prelevare recomandată |
| Sol | Cantitatea de eșantionare: aprox.5 g;Substanța uscată rămasă trebuie îndepărtată de pe suprafață;Se macină bucăți mari și se trece prin filtru de 2 mm;Probe alicote în tub EP steril sau cyrotube pentru rezervare. |
| Fecale | Cantitatea de eșantionare: aprox.5 g;Colectați și alicoți probe în tub EP steril sau criotub pentru rezervare. |
| Conținutul intestinal | Probele trebuie prelucrate în condiții aseptice.Se spală țesutul colectat cu PBS;Se centrifugă PBS și se colectează precipitantul în tuburi EP. |
| Namol | Cantitatea de eșantionare: aprox.5 g;Colectați și alicotați proba de nămol în tub EP steril sau criotub pentru rezervare |
| Corp de apa | Pentru eșantionul cu cantitate limitată de microbi, cum ar fi apa de la robinet, apa de puț etc., Colectați cel puțin 1 L de apă și treceți prin filtrul de 0,22 μm pentru a îmbogăți microbii de pe membrană.Depozitați membrana într-un tub steril. |
| Piele | Răzuiți cu atenție suprafața pielii cu un tampon de bumbac steril sau o lamă chirurgicală și puneți-o într-un tub steril. |
Livrare recomandată de mostre
Congelați probele în azot lichid timp de 3-4 ore și depozitați în azot lichid sau -80 de grade până la rezervare pe termen lung.Este necesară expedierea probei cu gheață uscată.
Fluxul de lucru al serviciului
Livrare mostre
Construcția bibliotecii
Secvențierea

Analiza datelor
Servicii post-vânzare
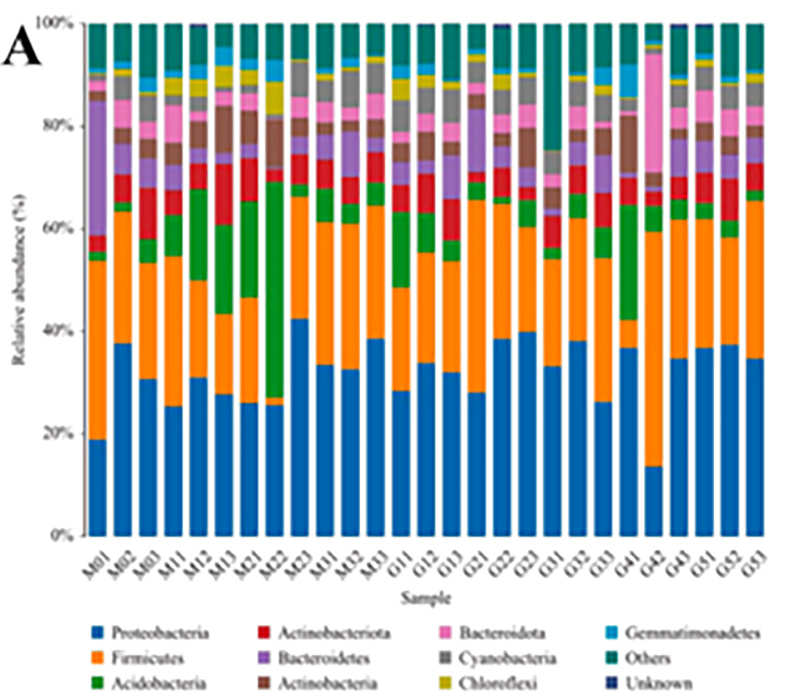
1.Histograma: Distribuția speciilor
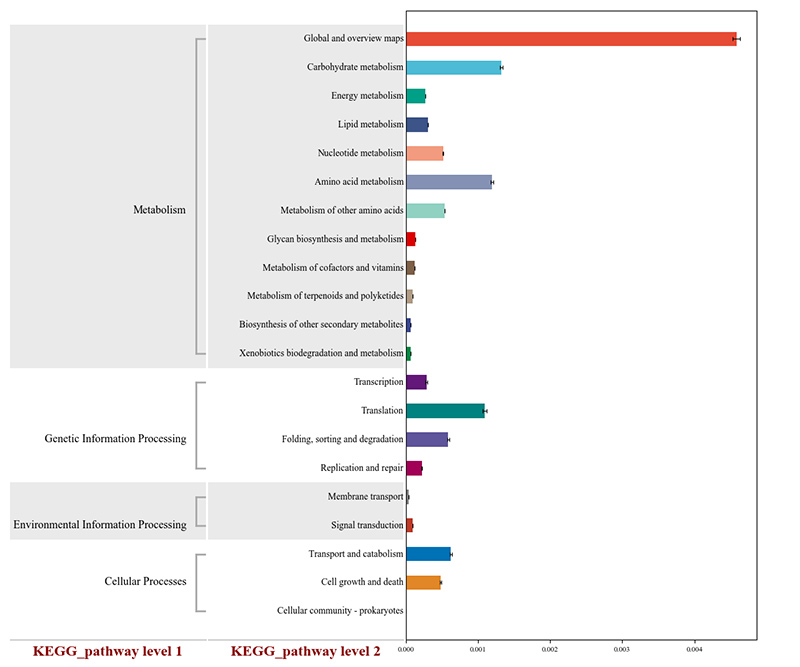
2.Gene funcționale adnotate la căile metabolice KEGG
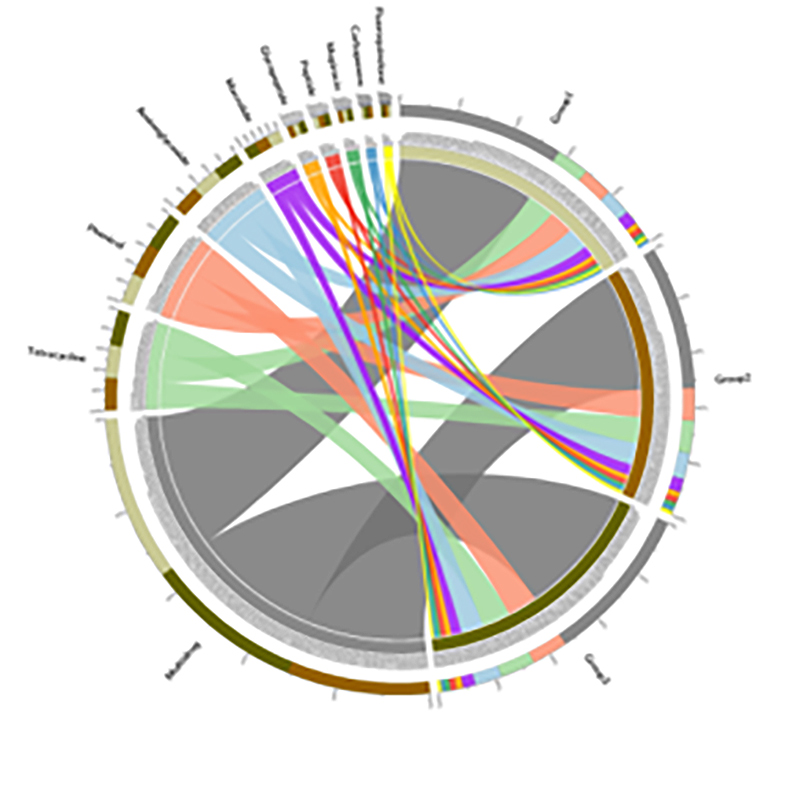
3. Harta termică: Funcții diferențiale bazate pe abundența relativă a genelor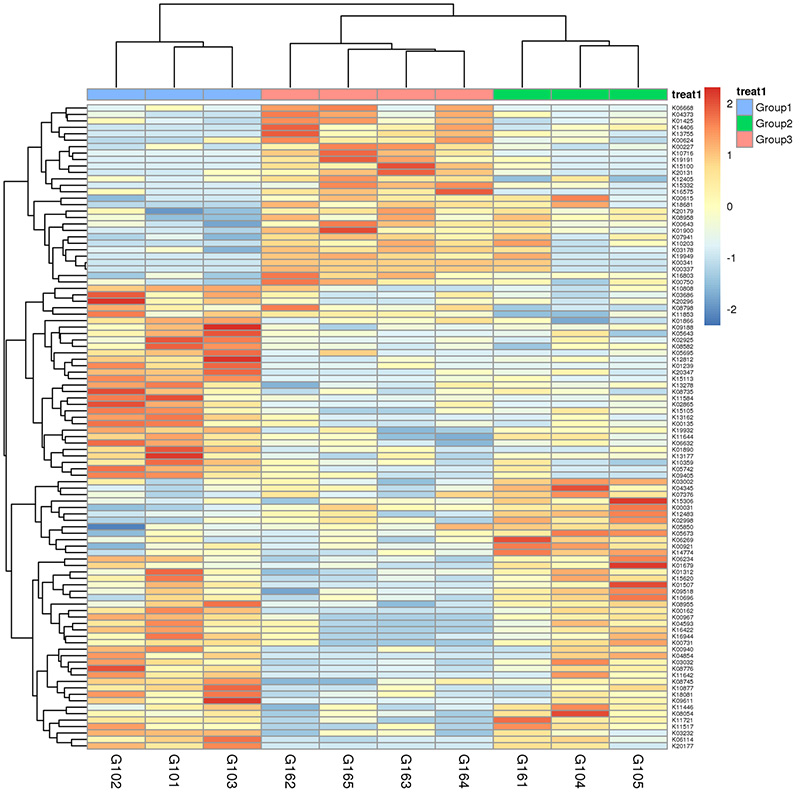 4.Circurile genelor de rezistență la antibiotice CARD
4.Circurile genelor de rezistență la antibiotice CARD
Carcasa BMK
Prevalența genelor de rezistență la antibiotice și a agenților patogeni bacterieni de-a lungul continuumului sol-rădăcină de mangrove
Publicat:Journal of Hazardous Materials, 2021
Strategia de secvențiere:
Materiale: extracte de ADN din patru fragmente de probe asociate rădăcinii de mangrove: sol neplantat, rizosferă, episferă și compartimente endosfere
Platformă: Illumina HiSeq 2500
Ținte: Metagenomul
Regiunea V3-V4 a genei ARNr 16S
Rezultate cheie
Secvențierea metagenomică și profilarea metabarcoding pe continuum sol-rădăcină a puieților de mangrove au fost procesate pentru a studia diseminarea genelor de rezistență la antibiotice (ARG) din sol în plante.Datele metagenomice au arătat că 91,4% dintre genele de rezistență la antibiotice au fost identificate în mod obișnuit în toate cele patru compartimente ale solului menționate mai sus, ceea ce a arătat o modă continuă.Secvențierea ampliconului ARNr 16S a generat 29.285 de secvențe, reprezentând 346 de specii.Combinând cu profilarea speciilor prin secvențierea ampliconilor, s-a constatat că această diseminare este independentă de microbiota asociată rădăcinilor, cu toate acestea, ar putea fi facilitată de elementele genetice mobile.Acest studiu a identificat fluxul de ARG și agenți patogeni din sol în plante printr-un continuum sol-rădăcină interconectat.
Referinţă
Wang, C., Hu, R., Strong, PJ, Zhuang, W. și Shu, L. .(2020).Prevalența genelor de rezistență la antibiotice și a agenților patogeni bacterieni de-a lungul continuumului sol-rădăcini de mangrove.Jurnalul de materiale periculoase, 408, 124985.











