
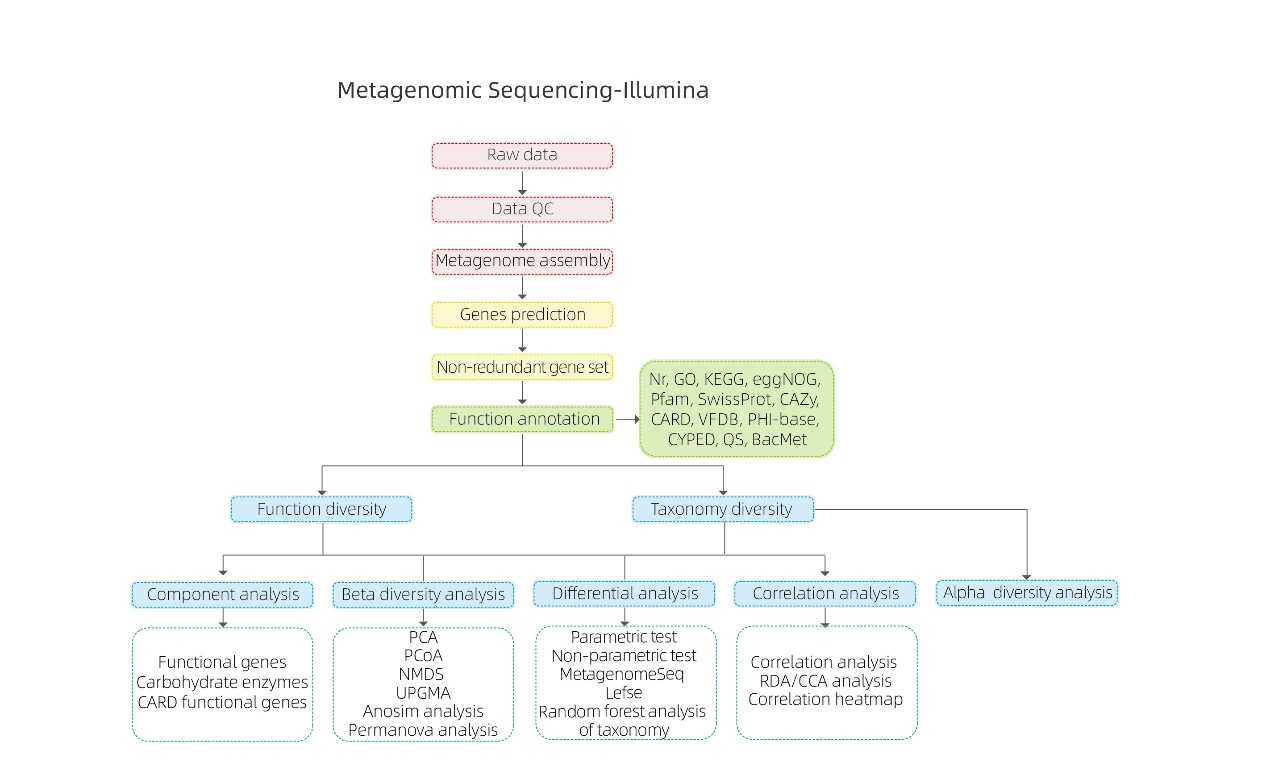
メタゲノムシーケンシング -NGS
サービスのメリット
● 微生物群集プロファイリングのための分離と培養が不要
● 環境サンプル中の微量種を高分解能で検出
● 「メタ」の考え方は、機能レベル、種レベル、遺伝子レベルですべての生物学的特徴を統合し、より現実に近いダイナミックな視点を反映します。
● BMK は、10,000 を超えるサンプルを処理し、さまざまな種類のサンプルについて膨大な経験を蓄積しています。
サービス仕様
| プラットホーム | シーケンス | 推奨データ | ターンアラウンドタイム |
| イルミナ NovaSeq プラットフォーム | PE150 | 6G/10G/20G | 45営業日 |
バイオインフォマティクス分析
●生データの品質管理
●メタゲノムアセンブリ
● 非重複遺伝子セットとアノテーション
●種の多様性分析
● 遺伝機能多様性解析
● グループ間分析
● 実験要因との関連分析
サンプルの要件と納品
サンプル要件:
のためにDNA抽出物:
| サンプルの種類 | 額 | 集中 | 純度 |
| DNA抽出物 | >30ng | > 1ng/μl | OD260/280=1.6-2.5 |
環境サンプルの場合:
| サンプルの種類 | 推奨されるサンプリング手順 |
| 土壌 | サンプリング量:約5g;残った枯れた物質は表面から取り除く必要があります。大きな断片を粉砕し、2 mm フィルターに通過させます。予約のために滅菌 EP チューブまたはサイロチューブにサンプルをアリコートします。 |
| 糞便 | サンプリング量:約5g;サンプルを収集し、予約のために滅菌 EP チューブまたはクライオチューブに分注します。 |
| 腸内容物 | サンプルは無菌条件下で処理する必要があります。採取した組織をPBSで洗浄します。PBS を遠心分離し、沈殿物を EP チューブに収集します。 |
| 汚泥 | サンプリング量:約5g;汚泥サンプルを収集し、予約のために滅菌 EP チューブまたはクライオチューブに分注します。 |
| 水域 | 水道水、井戸水など、微生物の量が限られたサンプルの場合は、少なくとも 1 L の水を集め、0.22 μm のフィルターを通過させ、膜上の微生物を濃縮します。メンブレンを滅菌チューブに保管します。 |
| 肌 | 滅菌綿棒または手術用ブレードで皮膚の表面を慎重にこすり、滅菌チューブに入れます。 |
推奨されるサンプル配信
サンプルを液体窒素で 3 ~ 4 時間凍結し、液体窒素または -80 度で長期保存します。サンプルの配送にはドライアイスが必要です。
サービスのワークフロー
サンプル納品
図書館の建設
シーケンス

データ分析
アフターサービス
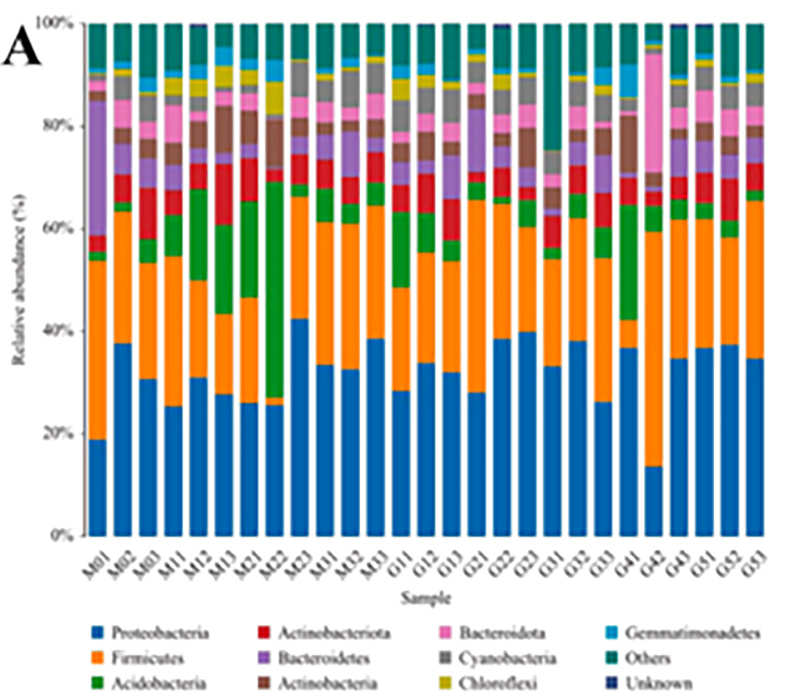
1.ヒストグラム: 種の分布
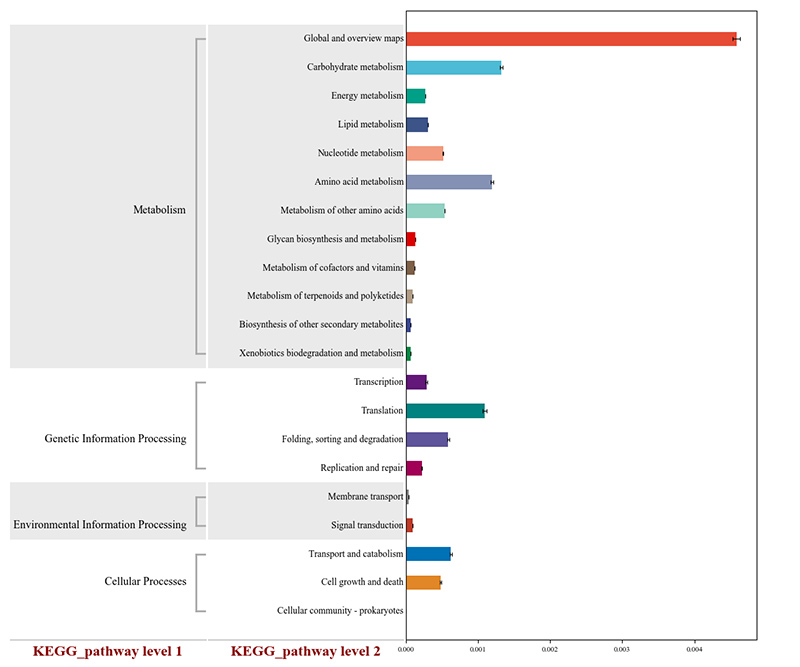
2.KEGG代謝経路に注釈が付けられた機能遺伝子
3.ヒートマップ: 相対的な遺伝子存在量に基づく機能の差異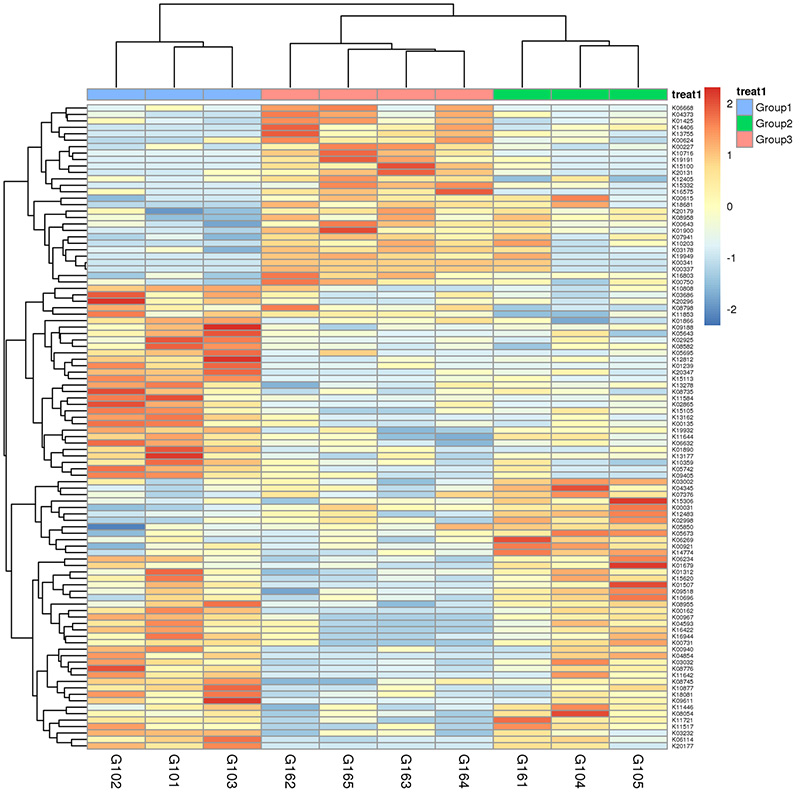 4.CARD抗生物質耐性遺伝子のCircos
4.CARD抗生物質耐性遺伝子のCircos
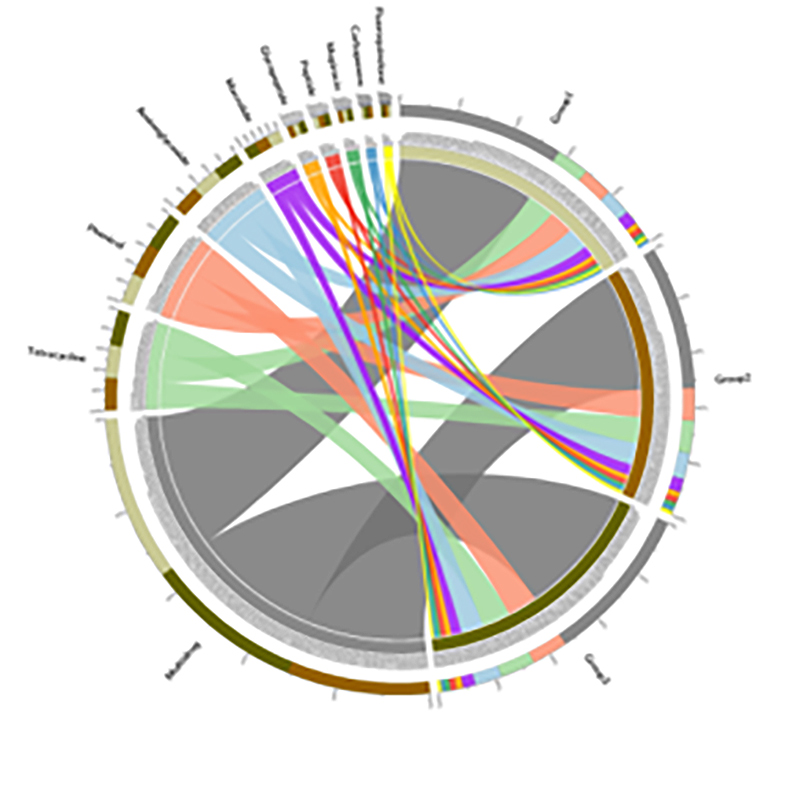
BMKケース
土壌とマングローブの根の連続体に沿った抗生物質耐性遺伝子と細菌性病原体の蔓延
公開日:危険物ジャーナル、2021 年
シーケンス戦略:
材料: マングローブの根に関連するサンプルの 4 つの断片の DNA 抽出物: 植林されていない土壌、根圏、表圏、および内圏の各区画
プラットフォーム: イルミナ HiSeq 2500
ターゲット: メタゲノム
16S rRNA 遺伝子 V3-V4 領域
主な結果
土壌から植物への抗生物質耐性遺伝子 (ARG) の伝播を研究するために、マングローブ苗木の土壌と根の連続体に関するメタゲノム シーケンスとメタバーコーディング プロファイリングが処理されました。メタゲノムデータにより、抗生物質耐性遺伝子の 91.4% が上記の 4 つの土壌区画すべてで共通に同定され、連続的な様式を示したことが明らかになりました。16S rRNA アンプリコン配列決定により、346 種に相当する 29,285 個の配列が生成されました。アンプリコン配列決定による種プロファイリングと組み合わせると、この伝播は根関連微生物叢とは無関係であることが判明しましたが、遺伝要素の移動によって促進される可能性があります。この研究では、相互接続された土壌と根の連続体を介して、土壌から植物へのARGと病原体の流れが特定されました。
参照
Wang, C. 、Hu, R. 、Strong, PJ 、Zhuang, W. 、Shu, L. .(2020年)。土壌とマングローブの根の連続体に沿った抗生物質耐性遺伝子と細菌性病原体の蔓延。危険物ジャーナル、 408、124985。











