KOKO GENOMIN TUTKIMUS

SARS-CoV-2:n genominen seuranta paljastaa Nsp1-deleetiovariantin, joka moduloi tyypin I interferonivastetta
Nanopore |Illumina |Koko genomin uudelleensekvensointi |metagenomiikka |RNA-Seq |Sanger
Biomarker Technologies tarjosi teknistä tukea näytteiden sekvensoinnissa tässä tutkimuksessa.
Kohokohdat
1.SARS-CoV-2-genomin sekvensointi ja fylogneettinen analyysi tunnistavat 35 toistuvaa mutaatiota, mukaan lukien 31 SNP:tä ja 4 indeliä.
2. Yhdistäminen 117 kliiniseen fenotyyppiin paljastaa potentiaalisen
tärkeitä mutaatioita.
∆500-532 Nsp1-koodausalueella korreloi alemman viruksen kanssa
3. kuormitus ja seerumi IFN-β.
4. Virusisolaatit, joissa on ∆500-532-mutaatio, indusoivat alemman IFN-I:n
vaste infektoituneissa soluissa.
Kokeellinen suunnittelu

Saavutukset
1. COVID-19:n epidemiologinen ja genominen seuranta
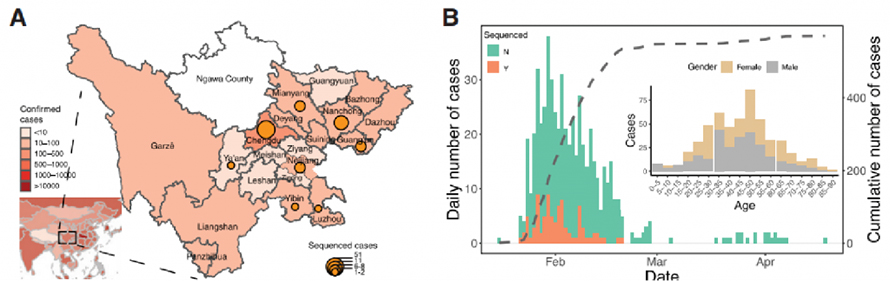
Kliiniset tiedot kerättiin Sichuanin maakunnassa Kiinassa epidemiajaksolta 22.1.2020–20.2.2020. Yhteensä 538 COVID-19-tapausta vahvistettiin qPCR-testeillä Sichuanissa, joista 28,8 % oli kotoisin maakunnasta. iso alkukirjain.Vahvistetut tapaukset Sichuanissa lisääntyivät eksponentiaalisesti ja saavuttivat huippunsa 30. tammikuuta.Tiedot tukivat myös sitä, että sosiaalinen etäisyys voi olla avaintekijä viruksen leviämisen estämisessä.
Kuva 1. Epidemiologinen tutkimus COVID-19:stä Sichuanin maakunnassa Kiinassa
2. SARS-CoV-2 genomin rakenne ja varianttien tunnistaminen
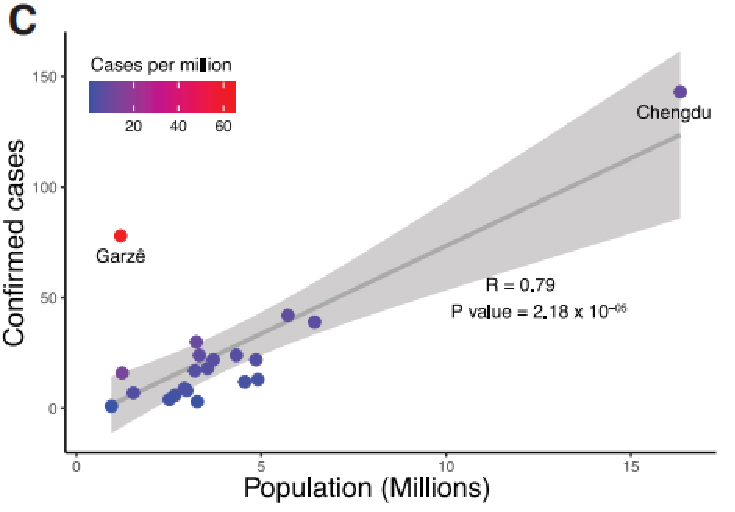
Multipleksisella PCR-amplifikaatiolla ja sitä seuranneella nanohuokosekvensoinnilla syntyi yhteensä 310 lähes tai osittain täydellistä genomia 248 potilaalta noin.80 % genomeista kattaa 10 lukua (Keskimääräinen syvyys: 0,39 M lukua näytettä kohti).
Kuva 2. Kunkin muunnelman esiintymistiheys Sichuanin kohortissa
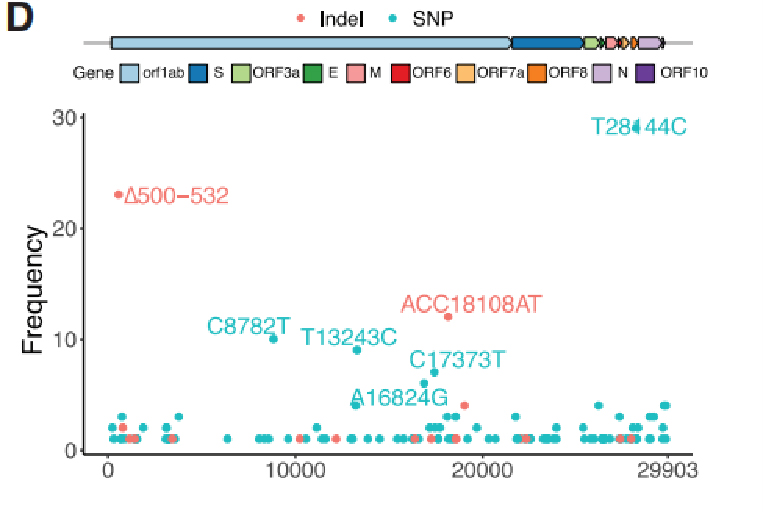
SARS-CoV-2-genomeista tunnistettiin yhteensä 104 SNP:tä ja 18 Indeliä, joista 31 SNP:tä ja 4 Indeliä tunnistettiin toistuviksi geneettisiksi muunnelmiksi.Vertaamalla niitä 169 näytteeseen Wuhanista ja 81 391 korkealaatuiseen julkiseen genomisekvenssiin GISAIDissa, 29 löydetystä 35 variantista esiteltiin muilla mantereilla.Erityisesti neljä varianttia, mukaan lukien ∆500-532, ACC18108AT, ∆729-737 ja T13243C, havaittiin esiintyvän vain Sichuanissa ja Wuhanissa, ja niitä puuttui GISAID-tiedoista, mikä osoittaa, että nämä variantit olivat hyvin todennäköisesti suojattuja Wuhanista, jotka täyttävät potilaiden matkakirjat.
Evoluutioanalyysi maksimitodennäköisyysmenetelmällä (ML) ja Bayesin molekyylikellolla käsiteltiin 88 uudella viruksella Sichuanista ja 250 kuratoidulla genomilla muilta alueilta.Genomeja, joissa oli ∆500-532 (deleetioita Nsp1:tä koodaavalla alueella), löydettiin harvakseltaan fylogeneettisessä puussa.Nsp1-varianttien haplotyyppianalyysi tunnisti 5 niistä useista kaupungeista.Nämä tulokset viittaavat siihen, että ∆500-532 esiintyi useissa kaupungeissa ja se saatettiin tuoda useita kertoja Wuhanista.
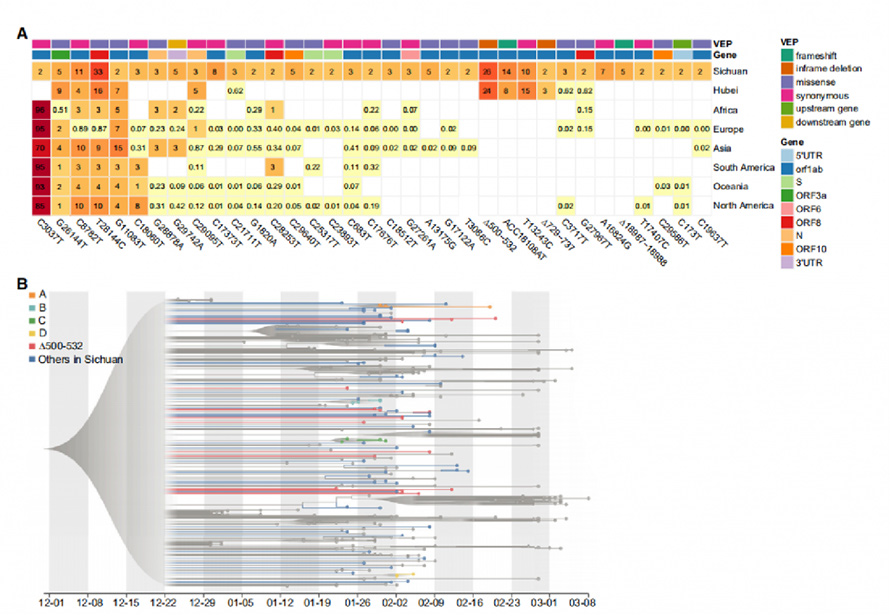
Kuva 2. Toistuvat geneettiset variantit ja fylogeneettinen analyysi SARS-CoV-2-genomeissa
3. Toistuvien geneettisten varianttien yhdistäminen kliinisiin vaikutuksiin
117 kliinistä fenotyyppiä yhdistettiin COVID-19:n vaikeusasteeseen, ja 19 vakavuusasteeseen liittyvää fenotyyppiä luokiteltiin vakaviin ja ei-vakaviin piirteisiin.Näiden piirteiden ja 35 toistuvan geneettisen muunnelman välinen suhde visualisoitiin bi-klusterin lämpökartassa.GSEA:n kaltainen rankattu rikastusanalyysi osoitti, että ∆500-532 korreloi negatiivisesti ESR:n, seerumin IFN-β- ja CD3+CD8+-T-solumäärien kanssa veressä.Lisäksi qPCR-testit osoittivat, että ∆500-532-viruksella tartunnan saaneilla potilailla oli korkein Ct-arvo eli pienin viruskuorma.
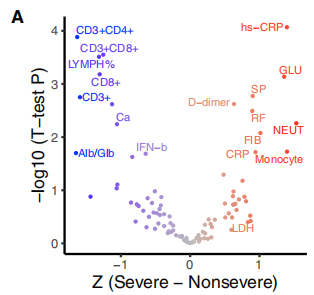
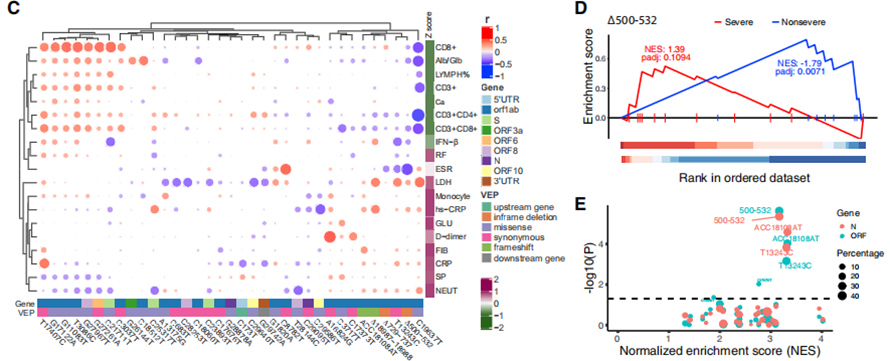
Kuva 3. 35 toistuvan geneettisen muunnelman assosiaatiot kliinisten fenotyyppien kanssa
4. Virusmutaatioihin liittyvien kliinisten fenotyyppien validointi
Jotta voitaisiin ymmärtää ∆500-532:n vaikutukset Nsp1-toimintoihin, HEK239T-solut transfektoitiin plasmideilla, jotka ilmensivät täyspitkiä, WT Nsp1- ja mutanttimuotoja, joissa oli deleetioita.Jokaisen käsitellyn HEK239T-solun transkriptiprofiilit käsiteltiin PCA-analyysiä varten, mikä osoitti, että deleetiomutantit ryhmittyivät suhteellisen lähemmäksi ja erosivat merkittävästi WT Nsp1:stä.Geenit, jotka lisääntyivät merkittävästi mutanteissa, rikastuivat pääasiassa "peptidien biosynteesi/aineenvaihduntaprosessissa", "ribonukleoproteiinikompleksin biogeneesissä", "proteiinin kohdentamisessa kalvoon/ER:ään" jne. Lisäksi kaksi deleetiota osoitti selkeän leviämiskuvion WT:stä.
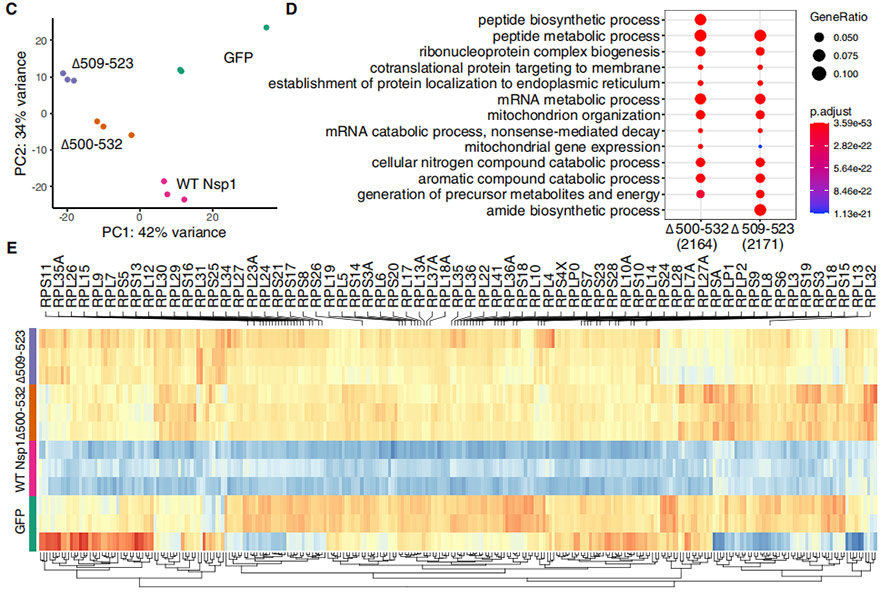
Kuva 4. WT Nsp1:llä transfektoitujen ja deleetioita sisältävien HEK239T-solujen transkriptioanalyysi
Deleetioiden vaikutuksia IFN-1-vasteeseen testattiin myös yli-ilmentyneessä tutkimuksessa.Kaikkien testattujen deleetioiden osoitettiin vähentävän IFN-1-resonia transfektoiduissa HEK239T- ja A549-soluissa sekä transkripti- että proteiinitasolla.Mielenkiintoista on, että deleetioissa merkittävästi heikentyneet geenit rikastuivat "puolustusvasteena virukselle", "viruksen genomin replikaatiolle", "RNA-polymeraasi II:n transkription säätelylle" ja "vaste tyypin I interferonille".
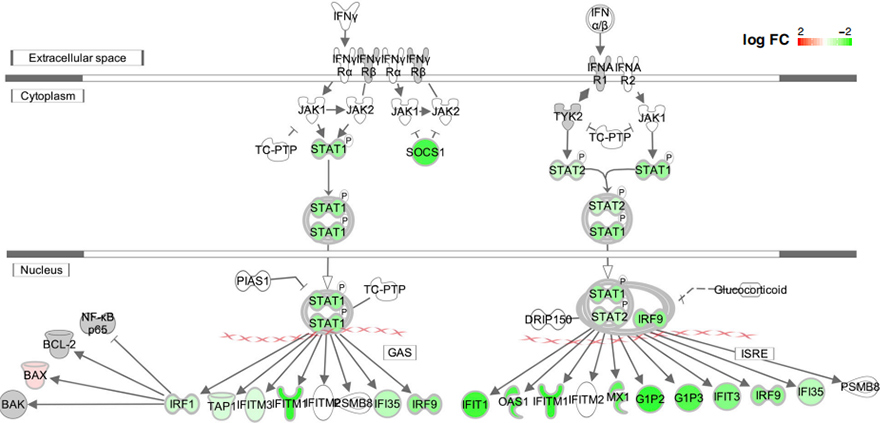
Kuva 5. Interferonin signalointireittien väheneminen ∆500-532-mutantissa
Tässä tutkimuksessa näiden deleetioiden vaikutus virukseen vahvistettiin edelleen virusinfektiotutkimuksilla.Virukset, joissa oli tiettyjä mutantteja, eristettiin kliinisistä näytteistä ja infektoitiin Calu-3-soluihin.Tarkemmat tulokset virusinfektiotutkimuksesta voidaan lukea lehdestä.
doi:10.1016/j.chom.2021.01.015
Viite
Lin J, Tang C, Wei H, et ai.SARS-CoV-2:n genominen seuranta paljastaa Nsp1-deleetiovariantin, joka moduloi tyypin I interferonivastetta[J].Soluisäntä ja mikrobi, 2021.
Uutisia ja kohokohtia Tavoitteena on jakaa uusimmat onnistuneet tapaukset Biomarker Technologiesin kanssa, vangita uusia tieteellisiä saavutuksia sekä tutkimuksen aikana käytettyjä merkittäviä tekniikoita.
Postitusaika: 06.01.2022

