TERVE GENOOMI ÜMBERSEKVEERIMINE

Hiina elanikkonna struktuurivariandid ja nende mõju fenotüüpidele, haigustele ja populatsiooni kohanemisele
Nanopore |PacBio |Kogu genoomi uuesti sekveneerimine |Struktuurse variatsiooni kutsumine
Selles uuringus pakkus Nanopore PromethION sekveneerimist Biomarker Technologies.
Esiletõstmised
Selles uuringus paljastati inimese genoomi struktuursete variatsioonide (SV) üldine maastik Nanopore PromethION platvormi kaualoetud sekveneerimise abil, mis süvendab SV-de mõistmist fenotüüpides, haigustes ja evolutsioonis.
Eksperimentaalne disain
Proovid: perifeerse vere leukotsüüdid 405 mitteseotud Hiina indiviidilt (206 meest ja 199 naist) 68 fenotüübilise ja kliinilise mõõtmisega.Kõigist isenditest olid 124 isendi esivanemate piirkonnad põhjapoolsed provintsid, 198 isendi omad olid lõunapoolsed, 53 edelaosad ja 30 ei olnud teada.
Sekveneerimisstrateegia: kogu genoomi pika lugemisega sekveneerimine (LRS) koos Nanopore 1D lugemistega ja PacBio HiFi lugemistega.
Järjestusplatvorm: Nanopore PromethION;PacBio järg II
Struktuuri variatsiooni kutsumine
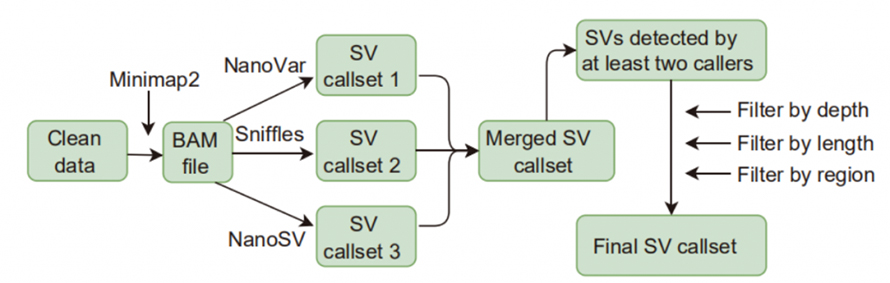
Joonis 1. SV-kõnede ja filtreerimise töövoog
Peamised saavutused
Struktuuri variatsioonide avastamine ja valideerimine
Nanopore dateset: PromethION sekveneerimisplatvormil genereeriti kokku 20,7 Tb puhast lugemist, saavutades keskmiselt 51 Gb andmeid proovi kohta, ca.17-kordne sügavus.
Võrdlusgenoomi joondamine (GRCh38): saavutati keskmine kaardistamismäär 94,1%.Keskmine veamäär (12,6%) oli sarnane eelneva võrdlusuuringuga (12,6%) (joonis 2b ja 2c).
Struktuurivariatsiooni (SV) kutsumine: selles uuringus kasutatud SV-helistajate hulka kuulusid Sniffles, NanoVar ja NanoSV.Kõrge usaldusväärsusega SV-d määratleti kui SV-d, mille tuvastas vähemalt kaks helistajat ja mis läbisid sügavuse, pikkuse ja piirkonna filtreerimise.
Igas proovis tuvastati keskmiselt 18 489 (vahemikus 15 439 kuni 22 505) kõrge usaldusväärsusega SV-d.(Joonis 2d, 2e ja 2f)
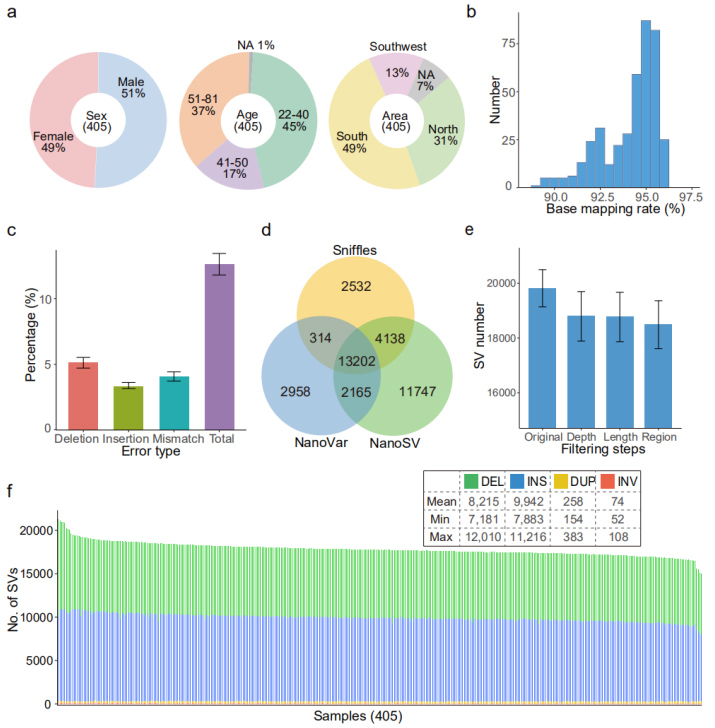
Joonis 2. Nanopore'i andmestikuga tuvastatud SV-de üldine maastik
Valideerimine PacBio poolt: ühes proovis tuvastatud SV-d (HG002, laps) valideeriti PacBio HiFi andmekogumiga.Üldine valede avastamise määr (FDR) oli 3,2%, mis illustreerib suhteliselt usaldusväärset SV tuvastamist Nanopore'i lugemiste abil.
Mitteliigsed SV-d ja genoomilised omadused
Mitteliigsed SV-d: kõigi proovide SV-de liitmisel saadi 132 312 mitteliigne SV-de komplekt, mis sisaldab 67 405 DEL-i, 60 182 INS-i, 3956 DUP-d ja 769 INV-d.(Joonis 3a)
Võrdlus olemasolevate SV andmekogumitega: seda andmekogumit võrreldi avaldatud TGS-i või NGS-i andmekogumiga.Neljas võrreldud andmekogumis jagas LRS15, mis on ka ainus kaualoetud järjestusplatvormi (PacBio) ainus andmestik, selle andmekogumiga suurimaid kattumisi.Veelgi enam, 53,3% (70 471) selle andmestiku SV-dest teatati esimest korda.Iga SV-tüüpi uurides oli pika lugemisega järjestuse andmestikuga taastatud INS-ide arv palju suurem kui ülejäänud lühiloetavatega, mis näitab, et pika lugemisega järjestamine on INS-ide tuvastamisel eriti tõhus.(Joonis 3b ja 3c)
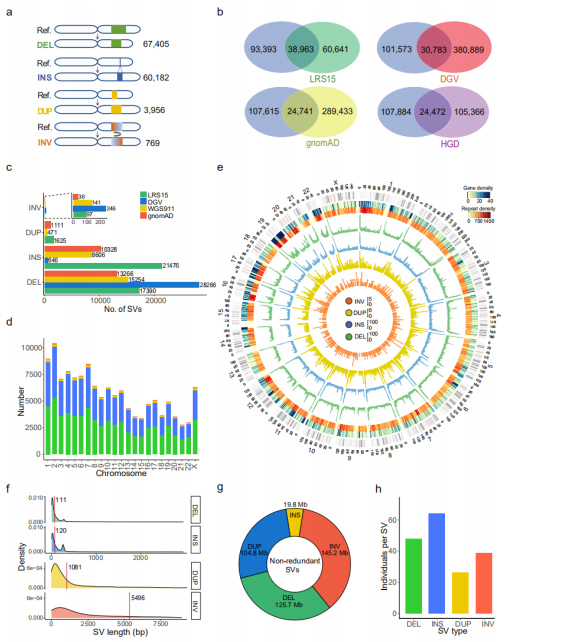
Joonis 3. Iga SV tüübi mitteliigsete SV-de omadused
Genoomilised tunnused: leiti, et SV-de arv on oluliselt korrelatsioonis kromosoomi pikkusega.Geenide, korduste, DEL-de (roheline), INS (sinine), DUP (kollane) ja INV (oranž) jaotus kuvati Circose diagrammil, kus kromosoomiharude lõpus täheldati üldist SV suurenemist.(Joonis 3d ja 3e)
SV-de pikkus: leiti, et INS-ide ja DEL-ide pikkused on oluliselt lühemad kui DUP-de ja INV-de omad, mis nõustusid PacBio HiFi andmestikuga tuvastatutega.Kõigi tuvastatud SV-de pikkus lisandus 395, 6 Mb-ni, mis hõlmas 13, 2% kogu inimese genoomist.SV-d mõjutasid keskmiselt 23,0 Mb (umbes 0,8%) genoomist indiviidi kohta.(Joonis 3f ja 3g)
SV funktsionaalsed, fenotüüpilised ja kliinilised mõjud
Prognoositav funktsiooni kadu (pLoF) SV-d: pLoF SV-d määratleti kui SV-d, mis interakteerusid CDS-iga, kus kodeerivad nukleotiidid kustutati või ORF-e muudeti.Kokku märgiti 1929 pLoF SV-d, mis mõjutasid 1681 geeni CDS-i.Nendes 38 geeni tõstsid GO rikastamise analüüsis esile "immunoglobuliini retseptori sidumise".Neid pLoF SV-sid märkisid täiendavalt vastavalt GWAS, OMIM ja COSMIC.(Joonis 4a ja 4b)
Fenotüübiliselt ja kliiniliselt olulised SV-d: mitmed nanopooride andmestiku SV-d on fenotüübiliselt ja kliiniliselt olulised.Haruldane 19,3 kb suurune heterosügootne DEL, mis teadaolevalt põhjustab alfa-talasseemiat, tuvastati kolmel isikul, kes häirisid hemoglobiini subühiku alfa 1 ja 2 (HBA1 ja HBA2) geene.Teine DEL 27,4 kb geenil, mis kodeerib hemoglobiini subühikut beeta (HBB), tuvastati teisel isikul.See SV põhjustas teadaolevalt tõsiseid hemoglobinopaatiaid.(Joonis 4c)
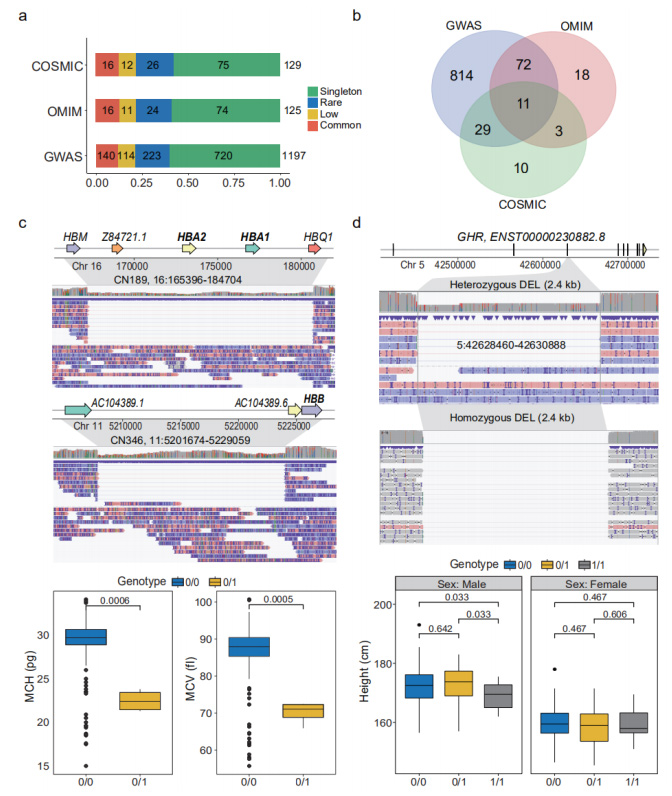
Joonis 4. Fenotüüpide ja haigustega seotud pLoF SV-d
35 homosügootses ja 67 heterosügootses kandjas täheldati tavalist 2,4 kb suurust DEL-i, mis katab kasvuhomooni retseptori (GHR) 3. eksoni täieliku piirkonna.Homosügootsed kandjad olid oluliselt lühemad kui heterosügootsed (p=0,033).(Joonis 4d)
Lisaks töödeldi neid SV-sid rahvastiku evolutsiooniuuringute jaoks kahe piirkondliku rühma vahel: Põhja- ja Lõuna-Hiina.Oluliselt diferentseeritud SV-d leiti jaotunud Chr 1, 2, 3, 6, 10, 12, 14 ja 19 piirkondades, millest ülemised olid seotud immuunsuspiirkondadega, nagu IGH, MHC jne. On mõistlik oletada, et Nende SV-de diferentseerumine võib olla tingitud geneetilisest triivist ja pikaajalisest kokkupuutest Hiina alampopulatsioonide mitmekesise keskkonnaga.
Viide
Wu, Zhikun jt."Hiina elanikkonna struktuurivariandid ja nende mõju fenotüüpidele, haigustele ja populatsiooni kohanemisele."bioRxiv(2021).
Uudised ja tipphetked eesmärk on jagada uusimaid edukaid juhtumeid ettevõttega Biomarker Technologies, jäädvustada nii uudseid teadussaavutusi kui ka uuringu käigus kasutatud silmapaistvaid tehnikaid.
Postitusaeg: jaanuar 06-2022

