МЕТАГЕНОМИЯ

Пълни, затворени бактериални геноми от микробиоми чрез секвениране на нанопори
Секвениране на нанопори |Метагеномика |MAG |Циркуляризация на бактериалния геном |Чревна микробиота
Акценти
1. Нов метод за извличане на дълги фрагменти от ДНК беше представен в това проучване, което постигна извличане на микрограм чиста HMW ДНК, подходяща за дълго четене на секвенции от 300 mg изпражнения
2. Работен процес на сглобяване, Lathe, беше въведен в това проучване, където MAG бяха сглобени чрез дълги четения и коригирани чрез къси четения.
3.Стругът беше оценен чрез макетна смес.7 от 12 бактерии бяха успешно сглобени в единични контиги и 3 бяха сглобени в четири или по-малко контиги.
4. Lathe беше допълнително приложен към проби от изпражнения, които генерираха 20 кръгови генома, включително Prevotella copri и кандидат Cibiobacter sp., които бяха известни с това, че са богати на мобилни генетични елементи.
Основно постижение
Протокол за извличане на HWM ДНК
Метагеномните проучвания на чревната последователност, базирани на дълго четене, отдавна страдат от трудности при извличането на ДНК с високо молекулно тегло (HMW) от изпражненията.В това проучване беше въведен протокол за екстракция, базиран на ензими, за да се избегне екстензивно срязване чрез биене на перли при традиционни методи.Както е показано на следващата фигура, пробите първо бяха третирани с коктейл от ензими, включително литичен ензим, MetaPolyzyme и др., за да се разградят клетъчните стени.Освободената ДНК се екстрахира чрез система фенол-хлороформ, последвано от смилане на протеиназа К и РНКаза А, пречистване на базата на колона и селекция на размера на SPRI.Този метод успя да даде микрограми HMW ДНК от 300 m изпражнения, което отговаря на дългогодишните изисквания за секвениране по отношение както на качество, така и на количество.
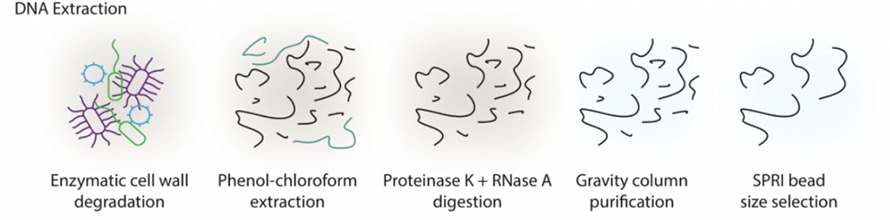
Фигура 1. Схема за екстракция на HWM ДНК
Схема поток на струг
Както е описано на следващата фигура, Lathe съдържа съществуващ процес на необработен базов процес с помощта на Guppy.След това от Flye и Canu се произвеждат две сглобки с дълго четене поотделно, последвани от откриване и отстраняване на неправилно сглобяване.Двата подвъзела се обединяват с Quickmerge.След сливането големите сглобки на ниво мегабаза след това се проверяват за циркуляризация.Впоследствие консенсусното усъвършенстване на тези сглобки се обработва с кратки четения.Окончателно сглобените бактериални геноми се обработват за окончателно откриване и отстраняване на неправилно сглобяване.
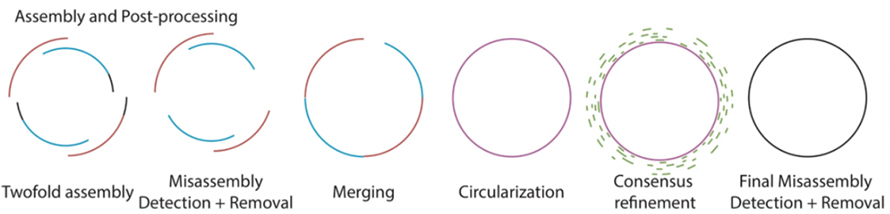
Фигура 2. Схема на сглобяване на струг
Оценка на струг с фалшива бактериална смес
Стандартна смес от 12 вида ATCC, включваща както грам-положителни, така и грам-отрицателни бактерии, беше използвана за оценка на ефективността на платформата за секвениране на нанопори и Lathe в MAG сглобяването.Общо 30,3 Gb данни бяха генерирани от нанопорна платформа с N50 от 5,9 kb.Lathe до голяма степен подобри сглобяването N50 до 1,6 до 4 пъти в сравнение с други отдавна прочетени инструменти за сглобяване и 2 до 9 пъти в сравнение с хибридните инструменти за сглобяване.От 12 бактериални генома, седем бяха сглобени в единични контиги (Фигура 3. Circos с черна точка).Още три бяха сглобени в четири или по-малко контига, в които най-непълният комплект съдържаше 83% от генома в един контиг.
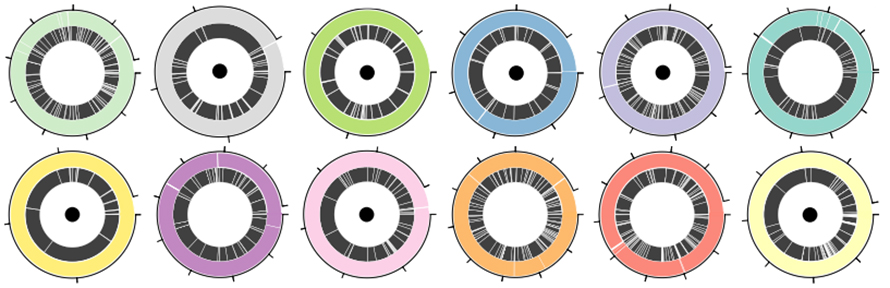
Фигура 3. Геномни сглобки в определена бактериална смес от 12 вида
Приложение на Lathe в проби от изпражнения
Този метод беше допълнително приложен към проби от човешки изпражнения, за да се сравни идентификацията на организма и съприкосновението на сглобяването със съществуващите методи, базиран на облак за четене и анализ на кратко четене.От трите включени проби, новата екстракция на базата на ензими дава най-малко 1 μg на 300 mg входяща маса.Секвенирането на нанопори на тези HMW ДНК генерира дълго четене с N50 съответно от 4,7 kb, 3,0 kb и 3,0 kb.Трябва да се отбележи, че настоящият метод показа голям потенциал за откриване на микроби в сравнение със съществуващите методи.Тук беше показано относително по-високо алфа разнообразие на видово ниво в сравнение с кратко четене и четене в облак.Освен това, всички родове от анализ на кратко четене, дори обикновено резистентни на лизис грам-положителни организми, бяха възстановени чрез този метод.
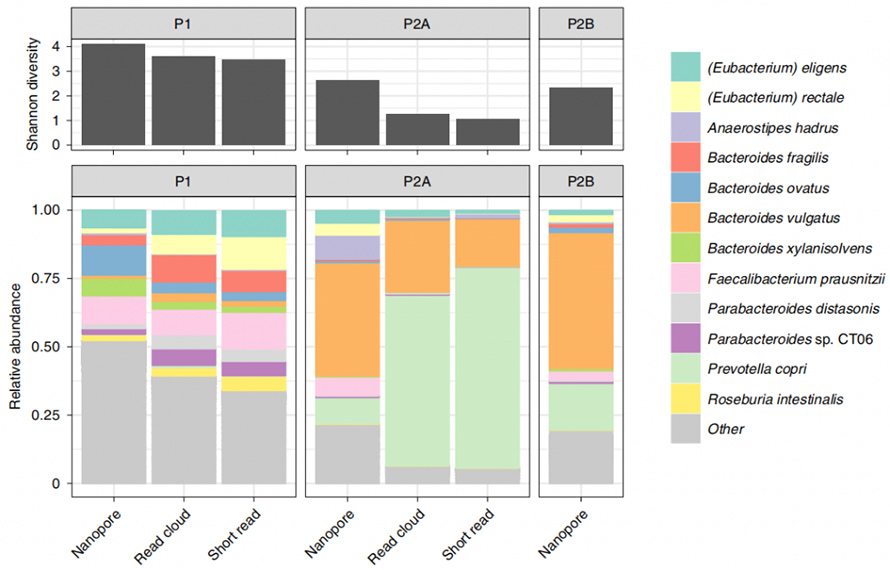
Фигура 4. Алфа разнообразие и таксаномични компоненти, определени чрез методите на Nanopore, кратко четене и четене в облак
Lathe даде много по-дълго цялостно сглобяване N50 от сглобяването за кратко четене и четене в облак, въпреки три до шест пъти по-ниско въвеждане на необработени данни.Проектите на геноми бяха произведени чрез contig binning, при което проектите бяха класифицирани като „висококачествени“ или „частични“ въз основа на пълнота, замърсяване, едно копие на основните гени и т.н. Сглобяването с дълго четене показа много по-висока близост при по-ниска цена в сравнение към кратко четене и четене в облак.
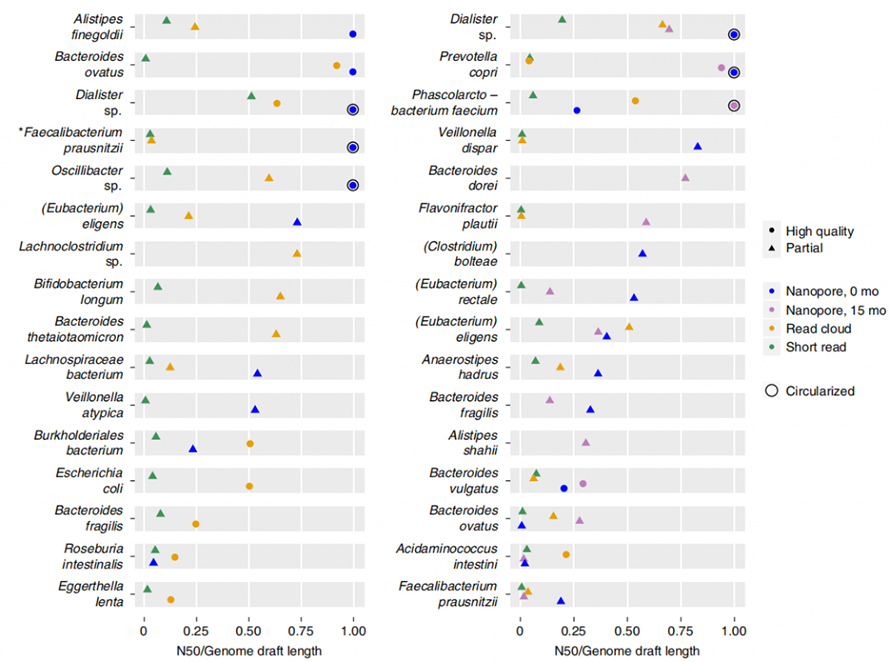
Фигура 5. Съседство на сглобяване на организъм за всеки метод
Освен това настоящият подход на сглобяване е в състояние да доведе до затворени, кръгови геноми.В пробите от изпражненията бяха събрани осем висококачествени генома с един контиг и пет от тях постигнаха прецизна циркуляризация.Подходът за дълго четене също показа впечатляващ капацитет за разрешаване на повтарящи се елементи в геномите.ЦиркуляризиранP. copriгеном е генериран чрез този подход, за който е известно, че съдържа висока степен на повторение на последователността.Най-доброто сглобяване на този геном чрез кратко четене и четене в облак никога не надвишава N50 от 130 kb, дори при дълбочина на покритие от 4800X.Тези елементи с висок брой копия бяха напълно решени чрез подхода за дълго четене, който често се среща в точките на прекъсване на сглобки за кратко четене или четене в облак.В това проучване беше докладван друг затворен геном, за който се смяташе, че е член на наскоро описанияCibiobacterклада.Пет предполагаеми фага бяха идентифицирани в тази затворена група, вариращи от 8,5 до 65,9 kb.
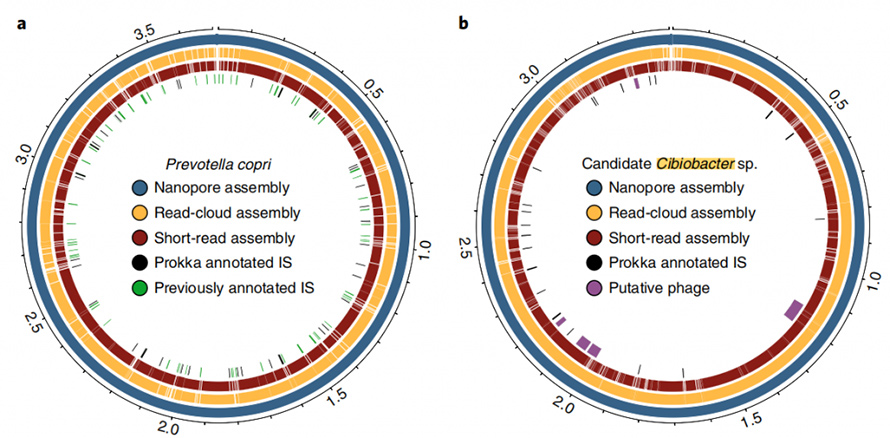
Фигура 6. Circos диаграма на затворени геноми на P.copri и Cibiobacter sp.
справка
Moss, EL, Maghini, DG, & Bhatt, AS (2020).Пълни, затворени бактериални геноми от микробиоми чрез секвениране на нанопори.Природни биотехнологии,38(6), 701-707.
Технологии и акценти има за цел да сподели най-новото успешно приложение на различни технологии за секвениране с висока производителност в различни изследователски среди, както и брилянтни идеи в експерименталния дизайн и извличането на данни.
Време на публикуване: 7 януари 2022 г

